
【题目】马里诺娃博士找到了一种比二氧化碳有效![]() 倍的“超级温室气体”全氟丙烷
倍的“超级温室气体”全氟丙烷![]() ,并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是( )
,并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是( )
A.分子中三个碳原子可能处于同一直线上
B.相同压强下,沸点:![]()
C.全氟丙烷的电子式为:![]()
D.全氟丙烷中既有极性键又有非极性键
科目:高中化学 来源: 题型:
【题目】硫化氢是一种急性剧毒气体,回收硫化氢解决了环境污染问题也可变废为宝。其反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l) △H=-632 kJ·mol-1。在酸性固体电解质环境下,硫化氢的处理原理图如图所示。下列说法正确的是

A.电极a的电极反应式为2H2S-4e-=S2+4H+
B.电子由电极a经质子固体电解质膜流向电极b
C.1 mol的H2S气体完全反应得到固体S2和水蒸气放热316kJ
D.负载中电流的方向自上而下
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种锂离子电池,在室温条件下可进行循环充放电,实现对磁性的可逆调控。一极为纳米Fe2O3,另一极为金属锂和石墨的复合材料,电解质只传导锂离子。电池总反应为:Fe2O3+6Li![]() 2Fe+3Li2O,关于此电池,下列说法不正确的是
2Fe+3Li2O,关于此电池,下列说法不正确的是
A.放电时,此电池逐渐靠近磁铁
B.放电时,正极反应为Fe2O3+6Li++6e-= 2Fe+3Li2O
C.放电时,正极质量减小,负极质量增加
D.充电时,阴极反应为Li++e-=Li
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砂质土壤分析中常用KarlFischer法是测定其中微量水含量,该方法原理是I2和SO2反应定量消耗水(假设土壤中其他成分不参加反应),据此回答下列问题:
(1)写出该反应的化学反应方程式:________________________。
步骤①:消耗反应样品中的水
下图是某同学在实验室模拟KarlFischer法的实验装置图:
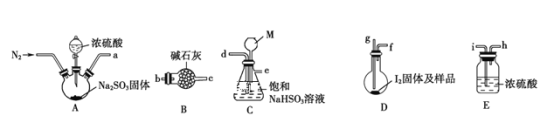
(2)装置连接的顺序为a__________(填接口字母顺序);M仪器的名称为__________,其在实验过程中的作用是__________________________。
(3)操作步骤①:连接装置并检查装置气密性,装入药品,_________________;关闭弹簧夹,打开分液漏斗活塞;反应结束后,关闭分液漏斗活塞,继续通入N2,取下D装置;步骤②:测定剩余的碘时,向反应后的D装置加入蒸馏水,过滤,充分洗涤滤渣,并合并洗涤液和滤液,将其配成250.00mL溶液,取25.00mL用0.20mol·L-1Na2S2O3标准液滴定剩余的碘单质,已知反应如下:2S2O![]() +I2=S4O
+I2=S4O![]() +2I-。
+2I-。
(4)Na2S2O3标准液应装在________(填“酸式”“碱式”)滴定管中;上述操作中,合并洗涤液和滤液的目的是________________________________。
(5)滴定实验重复四次得到数据如下:
实验 | 1 | 2 | 3 | 4 |
消耗的标准液的体积/mL | 18.37 | 20.05 | 19.95 | 20.00 |
①若实验开始时,向D装置中加入10.00g土壤样品和10.16gI2(已知I2过量),则样品土壤中水的含量为________%(计算结果保留小数点后一位)。
②若Na2S2O3标准液已部分氧化变质,则水含量测定结果将________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用NaBr、浓硫酸、乙醇等为原料制备少量溴乙烷(反应装置如图所示):C2H5—OH+HBr![]() C2H5—Br+H2O
C2H5—Br+H2O
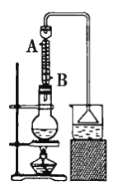
已知物质的用量:0.30molNaBr(s);0.25mol乙醇(密度为0.80g·cm-3);36mL浓硫酸(质量分数为98%,密度为1.84g·mL-1);25mL水。试回答下列问题:
(1)反应装置中烧瓶的容积应选择__(填序号)。
A.50mL B.100mL C.150mL D.250mL
(2)冷凝管中的冷凝水的流向应是__(填序号)。
A.A进B出 B.B进A出 C.从A进或B进均可
(3)实验完成后,需将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净的溴乙烷,应采取的操作是___。
(4)某同学在溴乙烷中加入NaOH乙醇溶液并加热,为判断其发生的是水解反应还是消去反应,则该同学向反应后的溶液中应加入的试剂是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有五种元素![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。
。![]() 元素为主族元素,
元素为主族元素,![]() 原子的
原子的![]() 层上有两个未成对电子且无空轨道;
层上有两个未成对电子且无空轨道;![]() 原子的价电子排布式为
原子的价电子排布式为![]() ;Z原子的
;Z原子的![]() 电子层的
电子层的![]() 亚层上有一个空轨道;
亚层上有一个空轨道;![]() 原子的
原子的![]() 电子层的
电子层的![]() 亚层上只有一对成对电子;
亚层上只有一对成对电子;![]() 原子的
原子的![]() 电子层上
电子层上![]() 轨道半充满。下列叙述不正确的是( )
轨道半充满。下列叙述不正确的是( )
A.元素![]() 和
和![]() 可形成化合物
可形成化合物![]()
B. ![]() 与
与![]() 的最高价氧化物对应的水化物,前者的酸性比后者强
的最高价氧化物对应的水化物,前者的酸性比后者强
C. ![]() 和
和![]() 结合生成的化合物为离子化合物
结合生成的化合物为离子化合物
D.![]() 是由极性键构成的非极性分子
是由极性键构成的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜元素可以形成多种重要化合物。回答下列问题:
(1)铜元素位于元素周期表中的__________区,其基态原子的价电子轨道表示式为__________。
(2)向硫酸铜溶液中加入过量氨水,可形成![]() 溶液,该溶液可用于溶解纤维素。
溶液,该溶液可用于溶解纤维素。
①![]() 中阴离子的立体构型是__________。
中阴离子的立体构型是__________。
②在![]() 中,
中,![]() 与
与![]() 之间形成的化学键称为__________,提供孤电子对的成键原子是__________。
之间形成的化学键称为__________,提供孤电子对的成键原子是__________。
③除硫元素外,![]() 中所含元素的电负性由小到大的顺序为_____(用元素符号表示)
中所含元素的电负性由小到大的顺序为_____(用元素符号表示)
④![]() 与
与![]() 的空间构型相同,中心原子的轨道杂化类型均为________。
的空间构型相同,中心原子的轨道杂化类型均为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)![]() 中含有离子键,
中含有离子键,![]() 不溶于有机溶剂而
不溶于有机溶剂而![]() 、
、![]() 、
、![]() 能够溶于乙醇、乙醚等有机溶剂,原因是__________。
能够溶于乙醇、乙醚等有机溶剂,原因是__________。
(2)《中华本草》等中医典籍中,记载了炉甘石(![]() )入药,可用于治疗皮肤炎症或表面创伤。
)入药,可用于治疗皮肤炎症或表面创伤。![]() 中,阴离子空间构型为__________,
中,阴离子空间构型为__________,![]() 原子的杂化形式为__________。
原子的杂化形式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关2个电化学装置的叙述正确的是

A. 装置①中,电子移动的路径是:Zn→Cu→CuSO4溶液→KCl盐桥→ZnSO4溶液
B. 在不改变总反应的前提下,装置①可用Na2SO4替换ZnSO4,用石墨替换Cu棒
C. 装置②中采用石墨电极,通电后,由于OH-向阳极迁移,导致阳极附近pH升高
D. 若装置②用于铁棒镀铜,则N极为铁棒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com