
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)![]() 中含有离子键,
中含有离子键,![]() 不溶于有机溶剂而
不溶于有机溶剂而![]() 、
、![]() 、
、![]() 能够溶于乙醇、乙醚等有机溶剂,原因是__________。
能够溶于乙醇、乙醚等有机溶剂,原因是__________。
(2)《中华本草》等中医典籍中,记载了炉甘石(![]() )入药,可用于治疗皮肤炎症或表面创伤。
)入药,可用于治疗皮肤炎症或表面创伤。![]() 中,阴离子空间构型为__________,
中,阴离子空间构型为__________,![]() 原子的杂化形式为__________。
原子的杂化形式为__________。
科目:高中化学 来源: 题型:
【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略)如下:

有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10 mL环己醇的A中,在55 ~ 60℃进行反应。反应完成后,加入适量水,蒸馏,收集95 ~ 100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的名称为____________________________。
(2)酸性Na2Cr2O7溶液氧化环己醇反应的![]() ,反应剧烈将导致体系温度迅速上升,副反应增多。
,反应剧烈将导致体系温度迅速上升,副反应增多。
①滴加酸性Na2Cr2O7溶液的操作为____________________________________________;
②蒸馏不能分离环己酮和水的原因是__________________________________________。
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加人无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是________________________________________________;
②B中水层用乙醚萃取的目的是______________________________________________;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有__________,操作d中,加入NaC1固体的作用是_____________________________。
(4)恢复至室温时,分离得到纯产品体积为6 mL,则环已酮的产率为____________。(计算结果精确到0.1%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马里诺娃博士找到了一种比二氧化碳有效![]() 倍的“超级温室气体”全氟丙烷
倍的“超级温室气体”全氟丙烷![]() ,并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是( )
,并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是( )
A.分子中三个碳原子可能处于同一直线上
B.相同压强下,沸点:![]()
C.全氟丙烷的电子式为:![]()
D.全氟丙烷中既有极性键又有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于
A.1.7B.2.0C.12.0D.12.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是电解饱和 NaCl 溶液的实验装置,x、y 都是惰性电极,a 是饱和 NaCl 溶液,同时在两边各滴入几滴酚酞试液,下列有关该实验正确的说法是

A.x 电极为阳极,y 电极为阴极
B.x 电极附近溶液变红色,且有刺激性气味气体产生
C.若将两电极产生的气体收集起来,X电极得到的气体与Y电极得到的气体之比之比略大于 1:1
D.电解后,将溶液混匀,电解前后溶液的 pH 未发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)据科技日报网报道,南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现烯丙醇高效、绿色合成。烯丙醇的结构简式为![]() 。请回答下列问题:
。请回答下列问题:
①基态镍原子的价电子排布式为________。
②![]() 键,烯丙醇分子中碳原子的杂化类型是__________。
键,烯丙醇分子中碳原子的杂化类型是__________。
(2)乙炔是有机合成的一种重要原料。实验室可用![]() 与水反应得到乙炔。
与水反应得到乙炔。
①将乙炔通入![]() 溶液中生成
溶液中生成![]() 红棕色沉淀。基态
红棕色沉淀。基态![]() 的核外电子排布式为____。
的核外电子排布式为____。
②乙炔与![]() 反应可得丙烯腈(
反应可得丙烯腈(![]() ),丙烯腈分子中碳原子的的杂化轨道类型是_______,分子中含有
),丙烯腈分子中碳原子的的杂化轨道类型是_______,分子中含有![]() 键的数目为___________。
键的数目为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含锂电解铝废渣(主要含 AlF3、 NaF、LiF、CaO ) 和浓硫酸为原料,制备电池级碳酸锂,同时得副产品冰晶石,其工艺流程如下:

已知LiOH易溶于水,Li2CO3微溶于水。回答下列问题:
(1)电解铝废渣与浓硫酸反应产生的气体化学式为 ___________。滤渣2的主要成分是(写化学式)_________。
(2)碱解反应中, 同时得到气体和沉淀反应的离子方程式为_____________。
(3)一般地说 K>105 时,该反应进行得就基本完全了。苛化反应中存在如下平衡:Li2CO3(s)+Ca2+(aq)2Li+(aq)+ CaCO3(s)通过计算说明该反应是否进行完全________(已知Ksp(Li2CO3) = 8.64×10-4、Ksp(CaCO3) = 2.5×10-9)。
(4)碳化反应后的溶液得到Li2CO3的具体实验操作有:加热浓缩、______、______、干燥。
(5)上述流程得到副产品冰晶石的化学方程式为__________。
(6)Li2CO3是制备金属锂的重要原料, 一种制备金属锂的新方法获得国家发明专利,其装置如图所示:

工作时电极 C 应连接电源的______极,阳极的电极反应式为__________ 。该方法设计的 A 区能避免熔融碳酸锂对设备的腐蚀和因________逸出对环境的污染。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有8种物质:①新戊烷 ②甲苯 ③聚乙烯 ④![]() ⑤2-丁炔 ⑥环己烷 ⑦邻二甲苯 ⑧2-甲基-1,3-丁二烯,既能和酸性高锰酸钾溶液反应又能与溴水反应的是
⑤2-丁炔 ⑥环己烷 ⑦邻二甲苯 ⑧2-甲基-1,3-丁二烯,既能和酸性高锰酸钾溶液反应又能与溴水反应的是
A.④⑤⑦⑧B.④⑦⑧C.④⑤⑧D.③④⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)可作为贮存水果的保鲜剂。现欲制备焦亚硫酸钠并探究其部分化学性质。
Ⅰ.制备Na2S2O5
可用试剂:饱和Na2SO3溶液、浓NaOH溶液、浓H2SO4、苯、Na2SO3固体(试剂不重复使用)。
焦亚硫酸钠的析出原理:2NaHSO3(饱和溶液)=Na2S2O5(晶体)+H2O(l)
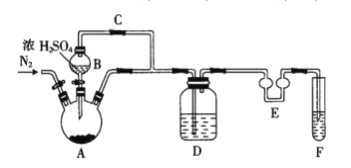
(1)如图装置中仪器A的名称是___。A中发生反应的化学方程式为___。仪器E的作用是___。
(2)F中盛装的试剂是___。
Ⅱ.探究Na2S2O5的还原性
(3)取少量Na2S2O5晶体于试管中,滴加1mL2mol/L酸性KMnO4溶液,剧烈反应,溶液紫红色很快褪去。反应的离子方程式为___。食品级焦亚硫酸钠可作为贮存水果保鲜剂的化学原理是防止食品___。
Ⅲ.测定Na2S2O5样品的纯度。
(4)将10.0gNa2S2O5样品溶解在蒸馏水中配制100mL溶液,取其中10.00mL加入过量的20.00mL0.3000mol/L的酸性高锰酸钾溶液,充分反应后,用0.2500mol/L的Na2SO3标准液滴定至终点,消耗Na2SO3溶液20.00mL,Na2S2O5样品的纯度为___%(保留一位小数),若在滴定终点时,俯视读数Na2SO3标准液的体积,会导致Na2S2O5样品的纯度___。(填“偏高”、“偏低”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com