
【题目】焦亚硫酸钠(Na2S2O5)可作为贮存水果的保鲜剂。现欲制备焦亚硫酸钠并探究其部分化学性质。
Ⅰ.制备Na2S2O5
可用试剂:饱和Na2SO3溶液、浓NaOH溶液、浓H2SO4、苯、Na2SO3固体(试剂不重复使用)。
焦亚硫酸钠的析出原理:2NaHSO3(饱和溶液)=Na2S2O5(晶体)+H2O(l)
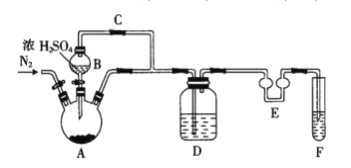
(1)如图装置中仪器A的名称是___。A中发生反应的化学方程式为___。仪器E的作用是___。
(2)F中盛装的试剂是___。
Ⅱ.探究Na2S2O5的还原性
(3)取少量Na2S2O5晶体于试管中,滴加1mL2mol/L酸性KMnO4溶液,剧烈反应,溶液紫红色很快褪去。反应的离子方程式为___。食品级焦亚硫酸钠可作为贮存水果保鲜剂的化学原理是防止食品___。
Ⅲ.测定Na2S2O5样品的纯度。
(4)将10.0gNa2S2O5样品溶解在蒸馏水中配制100mL溶液,取其中10.00mL加入过量的20.00mL0.3000mol/L的酸性高锰酸钾溶液,充分反应后,用0.2500mol/L的Na2SO3标准液滴定至终点,消耗Na2SO3溶液20.00mL,Na2S2O5样品的纯度为___%(保留一位小数),若在滴定终点时,俯视读数Na2SO3标准液的体积,会导致Na2S2O5样品的纯度___。(填“偏高”、“偏低”)
【答案】三颈烧瓶 Na2SO3+H2SO4=H2O+SO2↑+Na2SO4 防倒吸 浓NaOH溶液 5S2O52-+4MnO4-+2H+=10SO42-+4Mn2++H2O 氧化变质 95.0 偏高
【解析】
A三颈烧瓶中制备二氧化硫,发生Na2SO3+H2SO4=H2O+SO2↑+Na2SO4,生成的二氧化硫通入D装置,发生Na2SO3+SO2+H2O=2NaHSO3,2NaHSO3(饱和溶液)=Na2S2O5(晶体)+H2O(l),仪器E的作用是防倒吸,F吸收尾气。据此解答。
Ⅰ(1)装置中仪器A的名称是三颈烧瓶。A中发生反应的化学方程式为Na2SO3+H2SO4=H2O+SO2↑+Na2SO4。二氧化硫易溶于水,仪器E的作用是防倒吸。
故答案为:三颈烧瓶;Na2SO3+H2SO4=H2O+SO2+Na2SO4;防倒吸;
(2)二氧化硫有毒,排到空气中会污染空气,SO2是酸性氧化物,可用碱溶液吸收,题干中只提供了一种试剂--浓NaOH溶液,F中盛装的试剂是浓NaOH溶液。
故答案为:浓NaOH溶液;
Ⅱ.(3)取少量Na2S2O5晶体于试管中,滴加1mL2mol/L酸性KMnO4溶液,剧烈反应,溶液紫红色很快褪去,说明MnO4-将S2O52-氧化生成硫酸根离子。反应的离子方程式为5S2O52-+4MnO4-+2H+=10SO42-+4Mn2++H2O。食品级焦亚硫酸钠可作为贮存水果保鲜剂的化学原理是:利用焦亚硫酸钠的还原性,防止食品氧化变质。
故答案为:5S2O5-+4MnO4-+2H+=10SO42-+4Mn2++H2O;氧化变质;
Ⅲ.(4)由关系式:5SO32-~2MnO4-,用0.2500mol/L的Na2SO3标准液滴定至终点,消耗Na2SO3溶液20.00mL,剩余的n(MnO4-)=![]() ×0.2500mol/L×20.00×10-3L=2.000×10-3mol,再由5S2O52-+4MnO4-+2H+=10SO42-+4Mn2++H2O得:Na2S2O5样品的纯度为=
×0.2500mol/L×20.00×10-3L=2.000×10-3mol,再由5S2O52-+4MnO4-+2H+=10SO42-+4Mn2++H2O得:Na2S2O5样品的纯度为=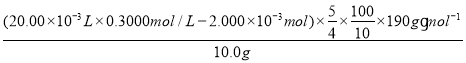 ×100%=95.0%;若在滴定终点时,俯视读数Na2SO3标准液的体积,使Na2SO3标准液的体积偏低,算出的剩余高锰酸钾偏低,与Na2S2O5样品反应的高锰酸钾偏高,会导致Na2S2O5样品的纯度偏高;
×100%=95.0%;若在滴定终点时,俯视读数Na2SO3标准液的体积,使Na2SO3标准液的体积偏低,算出的剩余高锰酸钾偏低,与Na2S2O5样品反应的高锰酸钾偏高,会导致Na2S2O5样品的纯度偏高;
故答案为:95.0;偏高。


科目:高中化学 来源: 题型:
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)![]() 中含有离子键,
中含有离子键,![]() 不溶于有机溶剂而
不溶于有机溶剂而![]() 、
、![]() 、
、![]() 能够溶于乙醇、乙醚等有机溶剂,原因是__________。
能够溶于乙醇、乙醚等有机溶剂,原因是__________。
(2)《中华本草》等中医典籍中,记载了炉甘石(![]() )入药,可用于治疗皮肤炎症或表面创伤。
)入药,可用于治疗皮肤炎症或表面创伤。![]() 中,阴离子空间构型为__________,
中,阴离子空间构型为__________,![]() 原子的杂化形式为__________。
原子的杂化形式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关2个电化学装置的叙述正确的是

A. 装置①中,电子移动的路径是:Zn→Cu→CuSO4溶液→KCl盐桥→ZnSO4溶液
B. 在不改变总反应的前提下,装置①可用Na2SO4替换ZnSO4,用石墨替换Cu棒
C. 装置②中采用石墨电极,通电后,由于OH-向阳极迁移,导致阳极附近pH升高
D. 若装置②用于铁棒镀铜,则N极为铁棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学通过查阅资料获得两个信息:一是在CaO存在的条件下,干燥的NaOH与干燥的CH3COONa混合加热可得到CH4;二是在加热条件下CH4可还原CuO。他们设计如下装置(加热仪器省略)制备CH4、还原CuO并验证B中有CO2、H2O生成。
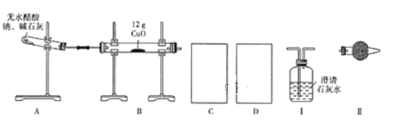
(1)为实现上述实验目的,C、D中的仪器应分别为_______________(填"Ⅰ、Ⅱ"或"Ⅱ、Ⅰ"),Ⅱ中的试剂是________________。
(2)A、B处均需要加热,实验中应先加热______处,表明B中有CO2生成的现象是_________。A中另一种生成物是常见的无机盐,A中反应的化学方程式为_________。
(3)实验表明,即使实验操作、使用试剂完全符合规范实验的要求,制备过程中试管仍会出现破裂情况,试分析其原因:________________。
(4)实验结束后,B中固体全部变成红色,甲同学通过查阅资料后认为,该固体可能是铜、氧化亚铜或者是二者的混合物,同时查得Cu2O在酸性条件下可转化为Cu、Cu2+。为确定红色固体的成分,他设计了如下两种方法。
①取少量红色固体于试管中,再向试管中加入足量的稀硫酸,判断含有Cu2O的现象是________,在常用的酸中,稀硫酸能不能换成稀硝酸_________(填“能”或“不能"),原因是_________。
②称量所得红色固体的质量,当固体质量(m)介于___________之间表明红色固体是Cu与Cu2O的混合物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别向体积相同、浓度均为1 mol/L的HA、HB两种酸溶液中不断加水稀释,酸溶液的pH与酸溶液浓度的对数(lg C)间的关系如图。下列对该过程相关分析正确的是
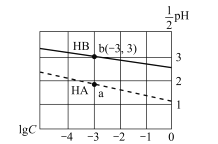
A. HB的电离常数(KA)数量级为10-3
B. 其钠盐的水解常数(Kh)大小关系是:NaB>NaA
C. a、b两点溶液中,水的电离程度b<a
D. 当lg C= -7时,两种酸溶液均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.6.0gSiO2晶体中含有共价键的数目为 0.2NA
B.标准状况下,22.4L甲醇中含有的 C-H 键数目为 0.3NA
C.室温下,53.5gNH4Cl晶体溶于氨水中,所得溶液 pH=7,NH![]() 的数目为NA
的数目为NA
D.用铅蓄电池电解氯化钠溶液,得到22.4L H2,铅蓄电池中消耗氢离子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素能够形成多种化合物。请回答下列问题:
(1)连氨(N2H4)常温下为液态,在空气中迅速完成燃烧生成N2,同时放出大量热,可作导弹、宇航飞船、火箭的燃料。
已知:H2(g)+![]() O2(g)═H2O(l)△H1=-285.8kJmol-1
O2(g)═H2O(l)△H1=-285.8kJmol-1
N2(g)+2H2(g)═N2H4(l)△H2=+50.6kJmol-1
则N2H4(l)在空气燃烧生成液态水的热化学方程式为______。
(2)工业上利用氨气生产氢氰酸(HCN)的反应CH4(g)+NH3(g)HCN(g)+3H2(g)△H>0。一定温度下,向2L恒容容器中充入1molCH4(g)和2molNH3(g)发生上述反应,4min达到平衡时,测得CH4的转化率为![]() 。0-4min内,用H2表示的该反应速率v(H2)=______。
。0-4min内,用H2表示的该反应速率v(H2)=______。
保持温度和容积不变,再向平衡后的容器中充入2molNH3和2molH2,此时v正______v逆(选填“>”“<”或“=”)。
(3)NH3能够形成Ag(NH3)2+。
①溶液中存在Ag+(aq)+2NH3(aq)Ag(NH3)2+(aq),其平衡常数的表达式为K稳=______。
②常温下,K稳[Ag(NH3)2+]=1.10×107,反应AgCl(s)+2NH3(aq)Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=1.936×10-3,则Ksp(AgCl)=______。
(4)硫氧化物和氮氧化物是常见的大气污染物,利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。
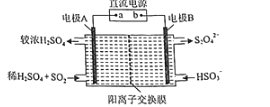
①电极A的电极反应式为______。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢、碳、氮、氧、铁、铜等元素及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
(1)写出基态铜原子的价电子排布式___。
(2)实验室用KSCN溶液、检验Fe3+。C、N、O的电负性由大到小的顺序为___(用元素符号表示),一定条件下,SCN-与MnO2反应可得到(SCN)2,试写出(SCN)2的结构式___。
(3)FeCl3的熔点为306℃,沸点为315℃FeCl3的晶体类型是__。FeSO4常作补铁剂,SO42-的立体构型是__。
(4)CH3OH分子中O原子的杂化方式为___,键角:H-C-H___H-O-C。(填“<”、“>”、“=”)CH3OH能与H2O以任意比互溶的原因是___。
(5)已知C60分子结构和C60晶胞示意图(如图I、图Ⅱ所示):
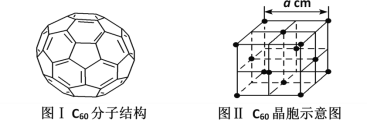
则一个C60分子中含有σ键的个数为__,与每个C60分子距离最近且相等的C60分子有__个,C60晶体的密度的表达式为__g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com