
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.6.0gSiO2晶体中含有共价键的数目为 0.2NA
B.标准状况下,22.4L甲醇中含有的 C-H 键数目为 0.3NA
C.室温下,53.5gNH4Cl晶体溶于氨水中,所得溶液 pH=7,NH![]() 的数目为NA
的数目为NA
D.用铅蓄电池电解氯化钠溶液,得到22.4L H2,铅蓄电池中消耗氢离子数为4NA
【答案】C
【解析】
A. 1mol SiO2中含4molSi-O共价键,6.0gSiO2晶体的物质的量为0.1mol,含有共价键的数目为 0.4NA,A错误;
B. 标准状况下,甲醇不是气体,无法计算,B错误;
C. 53.5gNH4Cl晶体的物质的量为1mol,根据电荷守恒,c(NH4+)+c(H+)=c(Cl-)+c(OH-),pH=7可知,c(H+)=c(OH-),则c(NH4+)=c(Cl-)=1mol,NH![]() 的数目为NA,C正确;
的数目为NA,C正确;
D. 用铅蓄电池电解氯化钠溶液,标准状况下,得到22.4LH2,转移电子的物质的量为2mol,铅蓄电池的正极电极反应式为PbO2+2e+4H+=Pb2++2H2O,可知消耗4mol的氢离子,所以理论上铅蓄电池中耗氢离子个数为4NA,但生成的氢气不一定在标况下,D错误;故答案为:C。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】(1)据科技日报网报道,南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现烯丙醇高效、绿色合成。烯丙醇的结构简式为![]() 。请回答下列问题:
。请回答下列问题:
①基态镍原子的价电子排布式为________。
②![]() 键,烯丙醇分子中碳原子的杂化类型是__________。
键,烯丙醇分子中碳原子的杂化类型是__________。
(2)乙炔是有机合成的一种重要原料。实验室可用![]() 与水反应得到乙炔。
与水反应得到乙炔。
①将乙炔通入![]() 溶液中生成
溶液中生成![]() 红棕色沉淀。基态
红棕色沉淀。基态![]() 的核外电子排布式为____。
的核外电子排布式为____。
②乙炔与![]() 反应可得丙烯腈(
反应可得丙烯腈(![]() ),丙烯腈分子中碳原子的的杂化轨道类型是_______,分子中含有
),丙烯腈分子中碳原子的的杂化轨道类型是_______,分子中含有![]() 键的数目为___________。
键的数目为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国成功研制出一种全新的铝-石墨双离子电池(AGDIB),这种新型AGDIB电池采用廉价且易得的石墨、铝箔作为电极材料,以常规锂盐和碳酸酯溶剂为电解液。该电池工作原理是:充电过程中,石墨发生阴离子插层反应,而铝电极发生铝-锂合金化反应,放电过程则相反。电池反应式为CxPF6+ LiyAl![]() Cx+LiPF6+ Liy-1Al,下列说法不正确的是
Cx+LiPF6+ Liy-1Al,下列说法不正确的是
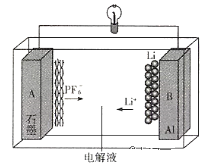
A.铝箔是电池负极
B.充电时,铝电极发生铝—锂合金化反应是还原反应
C.充电时A作阳极,放电时A电极的电极反应式为CxPF6+e-=Cx+![]()
D.废旧AGDIB电池进行“放电处理”,让Li+进入石墨中而有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 X 分子式为C3H6O,有多种同分异构体。其中之一丙醛(液态)的燃烧热为1815kJ/mol。下列说法不正确的是
A.X 的同分异构体中,含单官能团的共 5 种
B.1mol X 最多能和 1mol H2 加成
C.表示丙醛燃烧热的热化学方程式为:C3H6O(l)+4O2(g) = 3CO2 (g)+3H2O(l) △H=+1815kJ/mol
D.X 的同分异构体其中之一 CH2=CHCH2OH 可以发生取代反应、加成反应、加聚反应、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)可作为贮存水果的保鲜剂。现欲制备焦亚硫酸钠并探究其部分化学性质。
Ⅰ.制备Na2S2O5
可用试剂:饱和Na2SO3溶液、浓NaOH溶液、浓H2SO4、苯、Na2SO3固体(试剂不重复使用)。
焦亚硫酸钠的析出原理:2NaHSO3(饱和溶液)=Na2S2O5(晶体)+H2O(l)
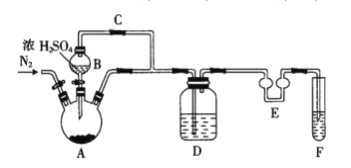
(1)如图装置中仪器A的名称是___。A中发生反应的化学方程式为___。仪器E的作用是___。
(2)F中盛装的试剂是___。
Ⅱ.探究Na2S2O5的还原性
(3)取少量Na2S2O5晶体于试管中,滴加1mL2mol/L酸性KMnO4溶液,剧烈反应,溶液紫红色很快褪去。反应的离子方程式为___。食品级焦亚硫酸钠可作为贮存水果保鲜剂的化学原理是防止食品___。
Ⅲ.测定Na2S2O5样品的纯度。
(4)将10.0gNa2S2O5样品溶解在蒸馏水中配制100mL溶液,取其中10.00mL加入过量的20.00mL0.3000mol/L的酸性高锰酸钾溶液,充分反应后,用0.2500mol/L的Na2SO3标准液滴定至终点,消耗Na2SO3溶液20.00mL,Na2S2O5样品的纯度为___%(保留一位小数),若在滴定终点时,俯视读数Na2SO3标准液的体积,会导致Na2S2O5样品的纯度___。(填“偏高”、“偏低”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
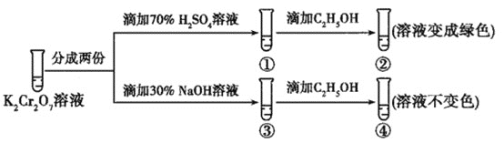
结合实验,下列说法不正确的是( )
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NOx 为主要成分的雾霾的综合治理是当前重要的研究课题。
I.汽车尾气中的 NO(g)和 CO(g)在一定条件下可发生反应生成无毒的N2 和 CO2:
(1)已知:①N2(g)+O2(g)![]() 2NO(g) △H1= +180.5 kJ·mol-1 ②CO 的燃烧热△H2 = - 283.0 kJ·mol-l,则反应③ 2NO(g)+2CO(g)
2NO(g) △H1= +180.5 kJ·mol-1 ②CO 的燃烧热△H2 = - 283.0 kJ·mol-l,则反应③ 2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H3 =_______。
N2(g)+2CO2(g) △H3 =_______。
(2)某研究小组在三个容积为 5 L 的恒容密闭容器中,分别充入 0.4mol NO 和 0.4 mol CO,发生反应③ 。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示:
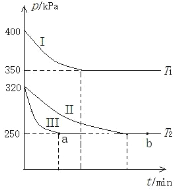
①温度:T1_____T2(填“<”“=”或“>”)。
②CO 的平衡转化率:Ⅰ_____Ⅱ_____Ⅲ(填“<”“=”或“>”)。
③反应速率:a 点的 v逆_____b 点的 v正 (填“<”“=”或“>”)。
④T2 时的平衡常数 Kc=_____。
(3)将 NO和 CO以一定的流速通过两种不同的催化剂(cat1、cat2)进行反应,相同时间内测量的脱氮率(脱氮率即 NO的转化率)如图所示。M 点_____(填“是”或“不是”)对应温度下的平衡脱氮率, 说明理由_________。
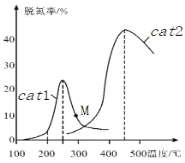
Ⅱ.N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解反应 2N2O=2N2+O2对环境保护有重要意义。
(4)碘蒸气存在能大幅度提高 N2O 的分解速率,反应历程为:
第一步 I2(g)![]() 2I(g)快速平衡,平衡常数为K
2I(g)快速平衡,平衡常数为K
第二步 I(g)+N2O(g)→N2(g)+IO(g) v = k1·c(N2O)·c(I) 慢反应
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+1/2I2(g) 快反应
其中可近似认为第二步反应不影响第一步的平衡。实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。
① k =_____(用含 K 和 k1 的代数式表示)。
②下列表述正确的是_____。
a.IO 为反应的中间产物
b.碘蒸气的浓度大小不会影响 N2O的分解速率
c.第二步对总反应速率起决定作用
d.催化剂会降低反应的活化能,从而影响△H
(5)通过 N2O 传感器可监测环境中 N2O 的含量,其工作原理如图所示
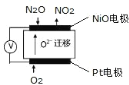
①NiO电极上的电极反应式为_____。
②N2O浓度越高,则电压表读数越_____。(填“高”或“低”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As2O3(砒霜)是两性氧化物(分子结构如图所示),溶于盐酸生成 AsCl3,AsCl3用 LiAlH4还原生成 AlH3。下列说法正确的是( )
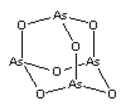
A.As2O3 分子中 As 原子的杂化方式为 sp
B.LiAlH4为共价化合物
C.AsCl3空间构型为平面正三角形
D.AlH3分子键角大于 109.5°
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.NH3 是极性分子,分子中 N 原子处在 3 个 H 原子所组成的三角形的中心
B.氨气易溶于水的原因之一是氨气分子与水分子之间能形成氢键
C.乙醇分子与水分子之间只存在范德华力
D.氯的各种含氧酸的酸性由强到弱的排列顺序为HClO>HClO2>HClO3>HClO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com