
【题目】以NOx 为主要成分的雾霾的综合治理是当前重要的研究课题。
I.汽车尾气中的 NO(g)和 CO(g)在一定条件下可发生反应生成无毒的N2 和 CO2:
(1)已知:①N2(g)+O2(g)![]() 2NO(g) △H1= +180.5 kJ·mol-1 ②CO 的燃烧热△H2 = - 283.0 kJ·mol-l,则反应③ 2NO(g)+2CO(g)
2NO(g) △H1= +180.5 kJ·mol-1 ②CO 的燃烧热△H2 = - 283.0 kJ·mol-l,则反应③ 2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H3 =_______。
N2(g)+2CO2(g) △H3 =_______。
(2)某研究小组在三个容积为 5 L 的恒容密闭容器中,分别充入 0.4mol NO 和 0.4 mol CO,发生反应③ 。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示:
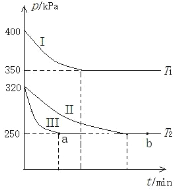
①温度:T1_____T2(填“<”“=”或“>”)。
②CO 的平衡转化率:Ⅰ_____Ⅱ_____Ⅲ(填“<”“=”或“>”)。
③反应速率:a 点的 v逆_____b 点的 v正 (填“<”“=”或“>”)。
④T2 时的平衡常数 Kc=_____。
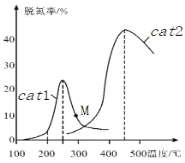
(3)将 NO和 CO以一定的流速通过两种不同的催化剂(cat1、cat2)进行反应,相同时间内测量的脱氮率(脱氮率即 NO的转化率)如图所示。M 点_____(填“是”或“不是”)对应温度下的平衡脱氮率, 说明理由_________。
Ⅱ.N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解反应 2N2O=2N2+O2对环境保护有重要意义。
(4)碘蒸气存在能大幅度提高 N2O 的分解速率,反应历程为:
第一步 I2(g)![]() 2I(g)快速平衡,平衡常数为K
2I(g)快速平衡,平衡常数为K
第二步 I(g)+N2O(g)→N2(g)+IO(g) v = k1·c(N2O)·c(I) 慢反应
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+1/2I2(g) 快反应
其中可近似认为第二步反应不影响第一步的平衡。实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。
① k =_____(用含 K 和 k1 的代数式表示)。
②下列表述正确的是_____。
a.IO 为反应的中间产物
b.碘蒸气的浓度大小不会影响 N2O的分解速率
c.第二步对总反应速率起决定作用
d.催化剂会降低反应的活化能,从而影响△H
(5)通过 N2O 传感器可监测环境中 N2O 的含量,其工作原理如图所示
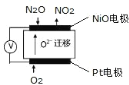
①NiO电极上的电极反应式为_____。
②N2O浓度越高,则电压表读数越_____。(填“高”或“低”)
【答案】-746.5 kJ/mol > < = > 17150 不是 该反应为放热反应,根据曲线cat2可知,M点对应温度的平衡脱氮率应该更高 k1 K1/2 ac N2O - 6e- + 3O2-=2NO2 高
【解析】
∣.(1)已知①N2(g)+O2(g)![]() 2NO(g) △H1= +180.5 kJ·mol-1;②CO+1/2O2=CO2 △H2 = - 283.0 kJ·mol-l;根据盖斯定律,②×2-①可得③,其△H3 = -746.5 kJ/mol,故答案为:-746.5 kJ/mol。
2NO(g) △H1= +180.5 kJ·mol-1;②CO+1/2O2=CO2 △H2 = - 283.0 kJ·mol-l;根据盖斯定律,②×2-①可得③,其△H3 = -746.5 kJ/mol,故答案为:-746.5 kJ/mol。
(2)①温度越高,反应速率越快,先达到平衡,由图可知,温度为T1时先拐,先达到平衡,所以T1>T2,故答案为:>。
②该反应的正反应为放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,已知T1>T2,所以CO的平衡转化率为:Ⅰ<Ⅱ=Ⅲ,故答案为:<;=。
③a、b点是平衡状态,所以正逆反应速率相等,由图像分析可知,a点加入了催化剂,反应速率加快,所以反应速率a点大于b点,a点的v逆大于b点的v正,故答案为:>。
④压强与物质的量成正比关系可得,![]() ,设平衡时,生成的氮气为xmol,则根据三段式:
,设平衡时,生成的氮气为xmol,则根据三段式:
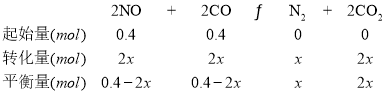
则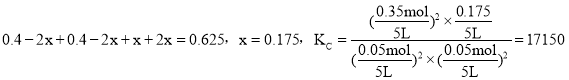 ,故答案为:17150。
,故答案为:17150。
(3)图象分析可知M点不是对应温度下的平衡脱氮率,温度较低时,催化剂的活性偏低;不是平衡脱氮率,因为该反应为放热反应,根据曲线cat2可知,M点对应温度的平衡脱氮率应该更高,故答案为:不是;该反应为放热反应,根据曲线cat2可知,M点对应温度的平衡脱氮率应该更高。
Ⅱ.(4)①根据 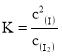 ,v=k·c(N2O)·[c(I2)]0.5,则
,v=k·c(N2O)·[c(I2)]0.5,则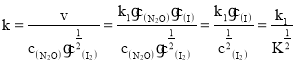 ,故答案为:
,故答案为:![]() ;
;
②a.IO是第二步反应的生成物,第三步反应的反应物,所以IO为反应的中间产物,a正确;
b.含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5,碘蒸气的浓度大小会影响 N2O的分解速率,b错误;
c.反应的快慢取决于慢反应,所以第二步对总反应速率起决定作用,c正确;
d.催化剂会降低反应的活化能,加快反应速率,不影响△H,d错误;故答案为:ac。
(5)①NiO电极上N2O反应生成NO2,N元素的化合价由+1价升高为+4价,发生氧化反应,NiO电极是负极,其电极反应为:N2O - 6e- + 3O2-=2NO2,Pt电极上O2反应生成O2-,O元素的化合价由0价降低为-2价,发生还原反应,Pt电极是正极,其电极反应为:O2 + 4e- =2O2-,故答案为:N2O - 6e- + 3O2-=2NO2。
②根据U=IR,N2O浓度越高,N2O越失去电子生成NO2,转移电子越多,电流越大,电压越大,电压表读数越高,故答案为:高。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】能源问题是现代社会发展的三大基本问题之一。
(1)焦炭可用于制取水煤气。实验测得1.2g碳与水蒸气完全反应生成水煤气时,吸收了13.16kJ热量。该反应的热化学方程式为___;该反应在条件下能自发进行___(选“高温”、“低温”或“任意温度”)。
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。

①T1___T2(填“>”、“<”或“=”)。T1和T2温度下的平衡常数大小关系是K1___(填“>”、“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是___(填字母)。
a.降低温度
b.将CH3OH(g)从体系中分离
c.使用合适的催化剂
d.充入He,使体系总压强增大
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示。则图中t2时采取的措施可能是___;t3时采取的措施可能是___。
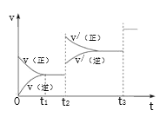
④若在T1℃时,往一密闭容器通入等物质的量CO和H2测得容器内总压强1MPa,40min达平衡时测得容器内总压强为0.6MPa,计算生成甲醇的压强平衡常数KP=___(MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学通过查阅资料获得两个信息:一是在CaO存在的条件下,干燥的NaOH与干燥的CH3COONa混合加热可得到CH4;二是在加热条件下CH4可还原CuO。他们设计如下装置(加热仪器省略)制备CH4、还原CuO并验证B中有CO2、H2O生成。
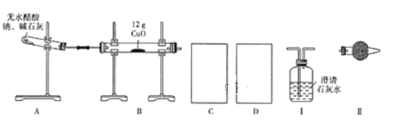
(1)为实现上述实验目的,C、D中的仪器应分别为_______________(填"Ⅰ、Ⅱ"或"Ⅱ、Ⅰ"),Ⅱ中的试剂是________________。
(2)A、B处均需要加热,实验中应先加热______处,表明B中有CO2生成的现象是_________。A中另一种生成物是常见的无机盐,A中反应的化学方程式为_________。
(3)实验表明,即使实验操作、使用试剂完全符合规范实验的要求,制备过程中试管仍会出现破裂情况,试分析其原因:________________。
(4)实验结束后,B中固体全部变成红色,甲同学通过查阅资料后认为,该固体可能是铜、氧化亚铜或者是二者的混合物,同时查得Cu2O在酸性条件下可转化为Cu、Cu2+。为确定红色固体的成分,他设计了如下两种方法。
①取少量红色固体于试管中,再向试管中加入足量的稀硫酸,判断含有Cu2O的现象是________,在常用的酸中,稀硫酸能不能换成稀硝酸_________(填“能”或“不能"),原因是_________。
②称量所得红色固体的质量,当固体质量(m)介于___________之间表明红色固体是Cu与Cu2O的混合物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.6.0gSiO2晶体中含有共价键的数目为 0.2NA
B.标准状况下,22.4L甲醇中含有的 C-H 键数目为 0.3NA
C.室温下,53.5gNH4Cl晶体溶于氨水中,所得溶液 pH=7,NH![]() 的数目为NA
的数目为NA
D.用铅蓄电池电解氯化钠溶液,得到22.4L H2,铅蓄电池中消耗氢离子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素能够形成多种化合物。请回答下列问题:
(1)连氨(N2H4)常温下为液态,在空气中迅速完成燃烧生成N2,同时放出大量热,可作导弹、宇航飞船、火箭的燃料。
已知:H2(g)+![]() O2(g)═H2O(l)△H1=-285.8kJmol-1
O2(g)═H2O(l)△H1=-285.8kJmol-1
N2(g)+2H2(g)═N2H4(l)△H2=+50.6kJmol-1
则N2H4(l)在空气燃烧生成液态水的热化学方程式为______。
(2)工业上利用氨气生产氢氰酸(HCN)的反应CH4(g)+NH3(g)HCN(g)+3H2(g)△H>0。一定温度下,向2L恒容容器中充入1molCH4(g)和2molNH3(g)发生上述反应,4min达到平衡时,测得CH4的转化率为![]() 。0-4min内,用H2表示的该反应速率v(H2)=______。
。0-4min内,用H2表示的该反应速率v(H2)=______。
保持温度和容积不变,再向平衡后的容器中充入2molNH3和2molH2,此时v正______v逆(选填“>”“<”或“=”)。
(3)NH3能够形成Ag(NH3)2+。
①溶液中存在Ag+(aq)+2NH3(aq)Ag(NH3)2+(aq),其平衡常数的表达式为K稳=______。
②常温下,K稳[Ag(NH3)2+]=1.10×107,反应AgCl(s)+2NH3(aq)Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=1.936×10-3,则Ksp(AgCl)=______。
(4)硫氧化物和氮氧化物是常见的大气污染物,利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。
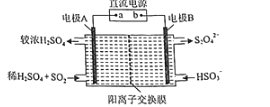
①电极A的电极反应式为______。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,X、Y、Z分别处于立方体的顶点、棱边的中点、立方体的体心。则下面关于该化合物的说法正确的是( )
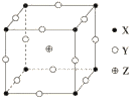
A. 该晶体的化学式为ZXY3
B. 该晶体的熔点一定比金属晶体熔点高
C. 每个X周围距离最近的Y有8个
D. 每个Z周围距离最近的X有16个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢、碳、氮、氧、铁、铜等元素及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
(1)写出基态铜原子的价电子排布式___。
(2)实验室用KSCN溶液、检验Fe3+。C、N、O的电负性由大到小的顺序为___(用元素符号表示),一定条件下,SCN-与MnO2反应可得到(SCN)2,试写出(SCN)2的结构式___。
(3)FeCl3的熔点为306℃,沸点为315℃FeCl3的晶体类型是__。FeSO4常作补铁剂,SO42-的立体构型是__。
(4)CH3OH分子中O原子的杂化方式为___,键角:H-C-H___H-O-C。(填“<”、“>”、“=”)CH3OH能与H2O以任意比互溶的原因是___。
(5)已知C60分子结构和C60晶胞示意图(如图I、图Ⅱ所示):
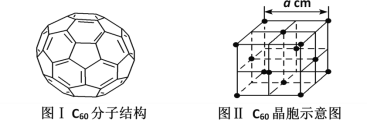
则一个C60分子中含有σ键的个数为__,与每个C60分子距离最近且相等的C60分子有__个,C60晶体的密度的表达式为__g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A是制取溴苯的实验装置,B、C是改进后的装置,请仔细分析,对比三个装置,回答以下问题:
A.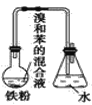 B.
B. 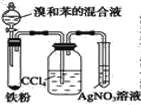 C.
C. 
(1)写出三个装置中所共同发生的主要反应的化学方程式:__________________。苯参与的反应的反应类型为________________
(2)装置 A 和 C 均采用了长玻璃导管,其作用是______________。
(3)在按装置 B 装好仪器及药品后要使反应开始,应对装置 B 进行的操作是_____________;分子式为 C8H10且属于苯的同系物的结构有_______________种。
(4)装置 B,C 较好地解决了 A 中加装药品和使装置及时密封的矛盾,方便了操作。A 装置中这一问题在实验中造成的后果是______________。
(5)B 中采用了洗气瓶吸收装置,其作用是_______________,反应后洗气瓶中可能出现的现象是_________________。
(6)B 装置也存在两个明显的缺点,使实验的效果不好或不能正常进行。这两个缺点是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于水解反应的是( )
A.CH2=CH2+H2O![]() CH3CH2OH
CH3CH2OH
B.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
C.CH3CH2Br+NaOH![]() CH3CH2OH+NaBr
CH3CH2OH+NaBr
D.CH3COOH+C2H5OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com