
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为________molL-1s-1,反应的平衡常数K1为_________

(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020molL-1s-1的平均速率降低,经10s又达到平衡。
①T_______100℃(填“大于”“小于”),判断理由是_____________________。
②列式计算温度T时反应的平衡常数K2 =________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向_______(填“正反应”或“逆反应”)方向移动,判断理由是__________________。
(4)已知:
甲醇脱水反应2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烃反应2CH3OH(g)=C2H4 (g)+H2O(g) △H2=-29.1kJ·mol-1
乙醇异构化反应2CH3OH(g)=CH3OCH3(g)) △H3=+50.7kJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H=____________ kJ·mol-1。
【答案】 大于 0.001 0.36 大于 c(N2O4)降低平衡正向移动,正反应为吸热反应,故温度升高 1.3 逆反应 增大压强平衡向气体体积减小的方向移动即逆反应方向 -45.5
【解析】本题分析:本题主要考查化学平衡。
(1)升温,平衡右移,反应的△H大于0;100℃时,在0~60s时段,N2O4减少0.060mol,反应速率v(N2O4)为0.001molL-1s-1,平衡浓度:c(N2O4)=0.040mol/L,c(NO2)=0.120mol/L,反应的平衡常数K1=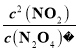 =0.36。
=0.36。
(2)①T大于100℃,判断理由是c(N2O4)降低平衡正向移动,正反应为吸热反应,故温度升高。
②平衡浓度:c(N2O4)=0.020mol/L,c(NO2)=0.160mol/L,平衡常数K2 = 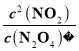 =1.3。
=1.3。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向逆反应方向移动,判断理由是增大压强平衡向气体物质的量减小的方向即逆反应方向移动。
(4)△H=△H1-2△H2-△H3=-45.5kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.由H原子形成1 mol H—H键要吸收热量
B.所有燃烧反应都是放热反应
C.在稀溶液中,1 mol酸与1 mol碱发生中和反应生成水时所释放的热量称为中和热
D.凡经加热而发生的化学反应都是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学生设计的用氨催化法制取少量HNO3溶液的实验装置如图所示: 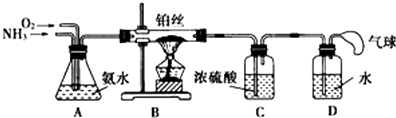
(1)实验室制备NH3 , 下列方法中适宜选用的是(填序号). ①固态氯化铵与熟石灰混合加热 ②固态氯化铵加热分解
③碱石灰中滴加浓氨水 ④氯化铵溶液与氢氧化钠溶液共热
(2)装置B中发生反应的化学方程式为 .
(3)装置C的作用是;装置C中的现象是;为确保装置D中尽可能多地生成HNO3 , 所通入O2和NH3的体积比应大于 .
(4)装置D中发生的反应化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去氯化镁酸性溶液中的铁离子,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是( )
A.一水合氨B.烧碱C.碳酸镁D.碳酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水与人的关系密切,人类的生存、生产、科研都离不开水。在通常状况下要证明一瓶无色无味的液体是纯水的方法,可靠的是
A. 测定其pH值B. 测定其导电性能C. 测定其熔沸点D. 验证其电解产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列关于生活用品的观点不合理的是
A. 保鲜膜、橡胶手套、棉布围裙,其主要材料属于天然纤维
B. 羽绒被、羊毛衫、羊皮袄,其主要成分属于蛋白质
C. 玻璃纸、乙醇、葡萄糖均可由纤维素得到
D. 漂白液、漂粉精均可用于游泳池以及环境的消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.18 g H2O在标准状况下的体积是22.4 L
B.22.4 L O2中一定含有6.02×1023个氧分子
C.在标准状况时,20 mL NH3与60 mL N2所含的原子个数比为2:3
D.将80 g NaOH溶于1 L水中,所得溶液中NaOH的物质的量浓度为2 moL/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com