
【题目】铝及其化合物在生产、生活中有极其广泛的用途。
(1)化学式Mg17Al12的合金是一种新型的纳米储氢合金,其储氢原来理为Mg17Al12+17H2=17MgH2+12Al,得到的混合物X(17MgH2+12Al)在一定条件下能释放出H2。
①MgH2中氢元素的化合价为____。
②将X与足量的NaOH溶液混合可得到H2,则766gX充分反应后可得到___molH2。
(2)将铝片放在汞盐溶液中,其表面会形成铝汞合金(铝表面的氧化膜被破坏了),从溶液中取出铝并放置在空气中,铝片表面会迅速长出胡须状的“白毛”(主要成分为Al2O3),同时放出大量的热.导致迅速长出“白毛”的原因可能有:一是铝、汞及介质共同形成了微小原电池,加速了铝的氧化反应;二是___。确定前一种可能原因是否存在的简单方法是___。
(3)无水AlCl3可用作有机合成的催化剂,工业上可用Al2O3、Cl2、焦炭混合反应制备无水AlCl3,该反应的另一种产物是可燃性气体,写出该反应的化学方程式:___。
(4)聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,它是应用广泛的高效净水剂。
①PAFC在强酸性和强碱性溶液中均会失去净水作用,原因是____。
②为检测PAFC中Al和Fe的含量,设计如图所示的流程:
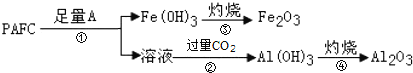
试剂A是____,步骤②中发生反应的离子方程式是____。
【答案】-1 35 汞作催化剂加速了铝的氧化反应 用汞和除去氧化膜的铝片在干燥的空气中作对比实验 Al2O3+3Cl2+3C=2AlCl3+3CO 强酸性和强碱性溶液中三价铁、三价铝离子无法形成相应胶体 氢氧化钠溶液 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
【解析】
(1)①因为镁为+2价,又化合物的化合价代数和为0,所以MgH2中氢元素的化合价为-1价,故答案为:-1;
②混合物X(17MgH2+12Al)与足量的NaOH溶液混合,铝与氢氧化钠反应还生成氢气,其方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,又766gX中含铝的物质的量为![]() ×12mol=12mol,所以生成氢气为
×12mol=12mol,所以生成氢气为![]() ×3mol=18mol,又766gX中含MgH2的物质的量为
×3mol=18mol,又766gX中含MgH2的物质的量为![]() ×17mol=17mol,所以一共可以达到(18+17)=35molH2,故答案为:35;
×17mol=17mol,所以一共可以达到(18+17)=35molH2,故答案为:35;
(2)因为加快反应速率,一是铝、汞及介质共同形成了微小原电池,加速了铝的氧化反应;二是汞作催化剂加速了铝的氧化反应;用汞和除去氧化膜的铝片在干燥的空气中作对比实验,如果铝片表面没有会迅速长出胡须状的“白毛”,则为铝、汞及介质共同形成了微小原电池,加速了铝的氧化反应,反之则不是,故答案为:汞作催化剂加速了铝的氧化反应;用汞和除去氧化膜的铝片在干燥的空气中作对比实验;
(3)因为工业上可用Al2O3、Cl2、焦炭混合反应制备无水AlCl3,该反应的另一种产物是可燃性气体根据原子守恒则为CO,所以方程式为Al2O3+3Cl2+3C=2AlCl3+3CO;故答案为:Al2O3+3Cl2+3C=2AlCl3+3CO;
(4)①因为三价铁、三价铝离子在水中发生水解生成氢氧化铁和氢氧化铝的胶体吸附水中悬浮杂质净水,在强酸性和强碱性溶液中三价铁、三价铝离子无法发生水解生成相应胶体,所以均会失去净水作用;故答案为:强酸性和强碱性溶液中三价铁、三价铝离子无法形成相应胶体;
②为检测PAFC中Al和Fe含量,PAFC加入足量A为氢氧化钠溶液反应生成氢氧化铁沉淀和偏铝酸钠溶液,过滤后得到氢氧化铁,灼烧得到氧化铁,滤液中通入过量二氧化碳气体,反应生成氢氧化铝沉淀,灼烧得到氧化铝;所以试剂A为氢氧化钠溶液,步骤②中的反应为偏铝酸钠溶液中通入过量二氧化碳气体生成氢氧化铝沉淀,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;故答案为:氢氧化钠溶液,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述不正确的是
A.用图 装置精炼铜,则a极为粗铜,电解质CuSO4溶液浓度变小
装置精炼铜,则a极为粗铜,电解质CuSO4溶液浓度变小
B.图 表示反应2SO2(g)+O2(g)
表示反应2SO2(g)+O2(g) ![]() 2SO3(g)增大O2的浓度对反应速率的影响
2SO3(g)增大O2的浓度对反应速率的影响
C.图 表示中和热测定的实验装置图
表示中和热测定的实验装置图
D.图 装置盐桥中KCl的Cl-移向左烧杯
装置盐桥中KCl的Cl-移向左烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2(g)+3H2(g) ![]() 2NH3(g) △H = -92.2 kJ/mol。下列说法不正确的是
2NH3(g) △H = -92.2 kJ/mol。下列说法不正确的是
A.1 mol N2(g)和3 mol H2(g)的能量之和高于2 mol NH3 (g)的能量
B.形成2 mol NH3(g)的化学键释放的总能量大于断裂1 mol N2 (g) 和3 mol H2 (g) 的化学键所吸收的总能量
C.加入催化剂是为了加大反应速率,缩短生产周期,降低生产成本
D.将1 mol N2(g)和3 mol H2(g)充入一密闭容器中充分反应,放出92.2 kJ 的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的钠、钾分别投入盛有相同浓度和体积的盐酸![]() 盐酸过量
盐酸过量![]() 的两个烧杯中,产生的气体的质量随时间变化曲线如图所示,则下列说法正确的是
的两个烧杯中,产生的气体的质量随时间变化曲线如图所示,则下列说法正确的是![]()
![]()
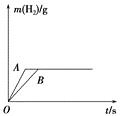
A.投入的Na、K的质量一定相等
B.投入的Na的质量大于K的质量
C.曲线A表示Na与盐酸反应,曲线B表示K与盐酸反应
D.该实验能证明K的金属性比钠的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验发现,298 K时,在FeCl3酸性溶液中加入少量锌粒后,Fe3+立即被还原成Fe2+。某化学兴趣小组根据该实验事实设计了如图所示的原电池装置。下列有关说法中正确的是()。
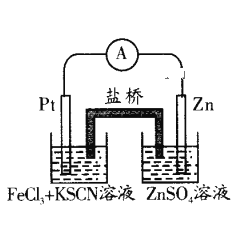
A.该原电池的正极反应:Zn-2e-=Zn2+
B.左边烧杯中溶液的红色逐渐褪去
C.该电池铂电极上有气泡生成
D.该电池总反应:3Zn+2Fe3+=2Fe+3Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下按如图安装好实验装置,在锥形瓶内盛6.5 g锌粒(颗粒大小基本相同),通过分液漏斗加入40 mL 2.5 mol/L的硫酸溶液,将产生的H2收集在一个注射器中,用时10 s时恰好收集到气体的体积为50 mL(若折合成0 ℃、101 kPa条件下的H2体积为44.8 mL),在该温度下,下列说法不正确的是( )
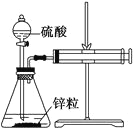
A. 用锌粒来表示10 s内该反应的速率为0.013 g/s
B. 忽略锥形瓶内溶液体积的变化,用H+来表示10 s内该反应的速率为0.01 mol/(L·s)
C. 忽略锥形瓶内溶液体积的变化,用Zn2+来表示10 s内该反应的速率为0.01 mol/(L·s)
D. 用H2来表示10 s内该反应的速率为0.000 2 mol/s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g) ![]()
![]() N2(g)+CO2(g);ΔH= -373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);ΔH= -373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z和W四种元素.已知:①![]() 、Y、Z属同一短周期,其离子以
、Y、Z属同一短周期,其离子以![]() 、
、![]() 、
、![]() 的形式存在。②
的形式存在。②![]() 和Z组成化合物
和Z组成化合物![]() 溶液遇苯酚呈紫色。请回答:
溶液遇苯酚呈紫色。请回答:
(1)Z的最高价氧化物对应水化物的名称为 ______
(2)X的单质在二氧化碳中燃烧的化学方程式为 ______
(3)Y的单质可用于冶炼金属锰,写出Y与二氧化锰反应的化学方程式 ______,Y的最高价氧化物对应的水化物既可溶于强酸又可溶于强碱,请用电离平衡理论解释其原因______
(4)当有![]() W组成的单质,在加热条件下与足量水完全反应,则生成气体标准状况下的体积为 ______ L
W组成的单质,在加热条件下与足量水完全反应,则生成气体标准状况下的体积为 ______ L
(5)我国陆地上冶炼X的主要流程如图所示:
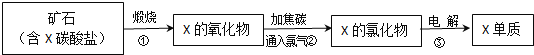 已知当有lmolX的氧化物参加反应时,有2mol电子转移且生成三种产物,则步骤②反应的化学方程式为 ______
已知当有lmolX的氧化物参加反应时,有2mol电子转移且生成三种产物,则步骤②反应的化学方程式为 ______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸香叶酯是一种食品香料,可由香叶醇与甲酸发生酯化反应制得。下列说法正确的是( )
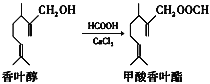
A.香叶醇的分子式为C11H18O
B.香叶醇在浓硫酸、加热条件下可发生消去反应
C.1 mol甲酸香叶酯可以与3 mol H2发生加成反应
D.甲酸香叶酯与新制的Cu(OH)2悬浊液共热可生成红色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com