
【题目】某温度下按如图安装好实验装置,在锥形瓶内盛6.5 g锌粒(颗粒大小基本相同),通过分液漏斗加入40 mL 2.5 mol/L的硫酸溶液,将产生的H2收集在一个注射器中,用时10 s时恰好收集到气体的体积为50 mL(若折合成0 ℃、101 kPa条件下的H2体积为44.8 mL),在该温度下,下列说法不正确的是( )
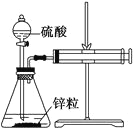
A. 用锌粒来表示10 s内该反应的速率为0.013 g/s
B. 忽略锥形瓶内溶液体积的变化,用H+来表示10 s内该反应的速率为0.01 mol/(L·s)
C. 忽略锥形瓶内溶液体积的变化,用Zn2+来表示10 s内该反应的速率为0.01 mol/(L·s)
D. 用H2来表示10 s内该反应的速率为0.000 2 mol/s
【答案】C
【解析】
0℃、101kPa为标况条件下,气体摩尔体积为22.4L/mol;化学反应速率,通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示;根据Zn+2H+=Zn2++H2↑反应,可算出用各物质表示的10s内该反应的速率。
0℃、101kPa条件下的H2体积为44.8mL,其物质的量为0.002mol,则根据Zn+H2SO4=ZnSO4+H2↑反应可知:Zn--H2SO4--ZnSO4---H2,n(Zn)= n(H2SO4)= n(ZnSO4)= n(H2)= 0.002mol;m(Zn)=0.002mol×65g/mol=0.13g,v(Zn)=0.13/10=0.013g/s,v(H+)=0.002×2/0.04×10=0.01mol/(L·s),v(Zn2+)=0.002/0.04×10=0.005mol/(L·s),v(H2)=0.002/10=0.0002mol/s;
A、用锌粒来表示10s内该反应的速率为0.013g/s,正确;
B、用H+来表示10s内该反应的速率0.01mol/(L·s),正确;
C、用Zn2+来表示10s内该反应的速率0.005mol/(L·s),错误;
D、用H2来表示10s内该反应的速率为0.0002mol/s,正确;
综上所述,本题选C。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.含有Fe3+的溶液中:K+、ClO-、SO42-、SCN-
B.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
C.由水电离产生的c(OH-)=1×10-13mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
D.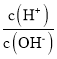 =1×1012的溶液中:NH4+、Al3+、NO3-、Cl-
=1×1012的溶液中:NH4+、Al3+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药用有机化合物A(C8H8O2)为一种无色液体。从A出发可发生如图所示的一系列反应。则下列说法正确的是( )
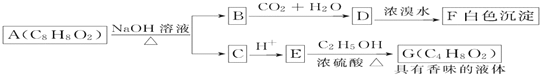
A.根据D和浓溴水反应生成白色沉淀可推知D为三溴苯酚
B.上述各物质中能发生水解反应的有A、B、D、G
C.G的同分异构体中属于酯且能发生银镜反应的有2种
D.1molA能与lmolNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.现有常温下浓度均为![]() 的下列四种溶液:
的下列四种溶液:![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液![]() 溶液。
溶液。
(1)这5种溶液pH由大到小的顺序是______,其中由水电离的H+浓度最小的是______。(填序号)
(2)②中各离子浓度由大到小的顺序是______,![]() 的水解平衡常数
的水解平衡常数![]() ______。
______。![]() 已知碳酸的电离常数
已知碳酸的电离常数![]() ,
,![]()
(3)向③中通入少量氨气,此时 的值______(填“增大”、“减小”或“不变”)。
的值______(填“增大”、“减小”或“不变”)。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积______ ④的体积(填“大于”、“小于”或“等于”)。
(5)将②③④的溶液分别蒸干并灼烧,最终可得原溶质的是______(填序号)。
(6)100mL3mol/LH2SO4溶液与足量的Zn反应,为减缓产生的H2速率但又不影响H2的总量,可采取的措施是______(填字母)。
A.加![]() 固体 B.加
固体 B.加![]() 固体 C.加
固体 C.加![]() 溶液 D.加氨水 E.加
溶液 D.加氨水 E.加![]() 溶液
溶液
II.常温下,向![]() 溶液中加入
溶液中加入![]() 溶液,可观察到的现象是______,发生反应的离子方程式为______,若将所得悬浊液的pH值调整为4,则溶液中
溶液,可观察到的现象是______,发生反应的离子方程式为______,若将所得悬浊液的pH值调整为4,则溶液中![]() 的溶液为______mol/L (已知常温下
的溶液为______mol/L (已知常温下![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物在生产、生活中有极其广泛的用途。
(1)化学式Mg17Al12的合金是一种新型的纳米储氢合金,其储氢原来理为Mg17Al12+17H2=17MgH2+12Al,得到的混合物X(17MgH2+12Al)在一定条件下能释放出H2。
①MgH2中氢元素的化合价为____。
②将X与足量的NaOH溶液混合可得到H2,则766gX充分反应后可得到___molH2。
(2)将铝片放在汞盐溶液中,其表面会形成铝汞合金(铝表面的氧化膜被破坏了),从溶液中取出铝并放置在空气中,铝片表面会迅速长出胡须状的“白毛”(主要成分为Al2O3),同时放出大量的热.导致迅速长出“白毛”的原因可能有:一是铝、汞及介质共同形成了微小原电池,加速了铝的氧化反应;二是___。确定前一种可能原因是否存在的简单方法是___。
(3)无水AlCl3可用作有机合成的催化剂,工业上可用Al2O3、Cl2、焦炭混合反应制备无水AlCl3,该反应的另一种产物是可燃性气体,写出该反应的化学方程式:___。
(4)聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,它是应用广泛的高效净水剂。
①PAFC在强酸性和强碱性溶液中均会失去净水作用,原因是____。
②为检测PAFC中Al和Fe的含量,设计如图所示的流程:
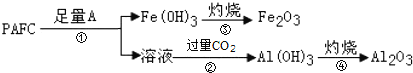
试剂A是____,步骤②中发生反应的离子方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g) + B(g) ![]() xC(g) + 2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol·L-1。下列判断错误的是
xC(g) + 2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol·L-1。下列判断错误的是
A. x=1
B. B的转化率为50%
C. 2min内A的反应速率为0.3mol·L-1·min-1
D. 若混合气体的平均相对分子质量不变,则表明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.比较去锈的铁钉和去锈的绕有细铜丝的铁钉与同浓度的盐酸反应速率快慢时,可以加![]() 溶液,观察铁钉周围出现蓝色沉淀的快慢
溶液,观察铁钉周围出现蓝色沉淀的快慢
B.将在空气中灼烧呈黑色的铜丝趁热插入盛有乙醇的试管中,铜丝变红色;反复数次,试管中的液体出现刺激性气味,表明乙醇已被铜氧化为乙醛
C.欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂![]() 或试纸
或试纸![]() 为:中和滴定实验、pH试纸
为:中和滴定实验、pH试纸
D.从海带中提取碘,可将灰化后的海带加入水中煮沸一段时间后过滤,向滤液中滴入几滴硫酸,再加入适量![]() 溶液氧化,最后加入
溶液氧化,最后加入![]() 萃取分离
萃取分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铵明矾[NH4Al(SO4)2·12H2O]是分析化学常用的基准试剂,工业上常用铝土矿(主要成分为Al2O3)来生产铵明矾,其中Z的水溶液可用于伤口消毒,其工艺流程图如下:
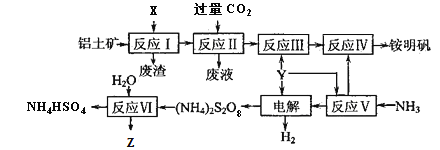
(1)写出反应Ⅱ的离子方程式____________________。
(2)25℃时,将0.2 mol·L-1的氨水与0.1 mol·L-1的Y溶液等体积混合,所得溶液的pH=5,则该温度下氨水的电离常数Kb≈_____________(忽略混合时溶液体积的变化)。
(3)从反应Ⅳ的铵明矾溶液中获得铵明矾晶体的实验操作依次为_____________、____________、过滤、洗涤(填操作名称)。
(4)“电解”时,用惰性材料作电极,则阳极电极反应式为__________________________。
(5)反应Ⅵ的化学方程式为______________________。
(6)废水中含有Fe2+、Mn2+等金属离子对自然环境有严重的破坏作用,,可用(NH4)2S2O8氧化除去。写出Mn2+被氧化生成MnO2的离子方程式为__________________________________。Z也有较强氧化性,在实际生产中不用Z氧化Mn2+的原因是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种兴奋剂的结构简式如图所示,有关该物质的说法不正确的是 ( )
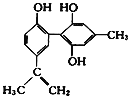
A.该分子中的所有碳原子可能共平面
B.该物质在一定条件下能发生加聚反应
C.滴入酸性KMnO4溶液,观察紫色褪去,能证明结构中存在碳碳双键
D.1 mol该物质与足量浓溴水反应时最多消耗Br2为4 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com