
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.含有Fe3+的溶液中:K+、ClO-、SO42-、SCN-
B.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
C.由水电离产生的c(OH-)=1×10-13mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
D.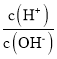 =1×1012的溶液中:NH4+、Al3+、NO3-、Cl-
=1×1012的溶液中:NH4+、Al3+、NO3-、Cl-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/L NaOH溶液滴定20mL 0.1mol/L CH3COOH溶液的滴定曲线如图。下列说法错误的是:

A.点①所示溶液中:c(CH3COO-)>c(CH3COOH)>c(Na+)>c(H+)>c(OH-)
B.点②所示溶液中:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
C.点①②③所示溶液中,均成立:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
D.点③表示整个滴定过程恰好达到滴定终点,在过程中溶液中![]() 始终不变
始终不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C △H <0,分两步进行 ① A+B→X △H>0 ② X→C △H<0 。下列示意图中,能正确表示总反应过程中能量变化的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与纯水的电离相似,液氨中也存在着微弱的电离:2NH3![]() NH4++NH2-,据此判断,以下叙述错误的是( )
NH4++NH2-,据此判断,以下叙述错误的是( )
A.一定温度下液氨中c(NH4+)·c(NH2-)是一个常数
B.液氨中含有NH3、NH4+、NH2-等粒子
C.液氨达到电离平衡时c(NH3)=c(NH4+)=c(NH2-)
D.只要不加入其他物质,液氨中c(NH4+)=c(NH2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述不正确的是
A.用图 装置精炼铜,则a极为粗铜,电解质CuSO4溶液浓度变小
装置精炼铜,则a极为粗铜,电解质CuSO4溶液浓度变小
B.图 表示反应2SO2(g)+O2(g)
表示反应2SO2(g)+O2(g) ![]() 2SO3(g)增大O2的浓度对反应速率的影响
2SO3(g)增大O2的浓度对反应速率的影响
C.图 表示中和热测定的实验装置图
表示中和热测定的实验装置图
D.图 装置盐桥中KCl的Cl-移向左烧杯
装置盐桥中KCl的Cl-移向左烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在下坡时,电池处于充电状态。
(1)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理如图1所示,其总反应式为H2+2NiOOH![]() 2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH___ (填“增大”、“减小”或“不变”),该电极的电极反应式为___。
2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH___ (填“增大”、“减小”或“不变”),该电极的电极反应式为___。
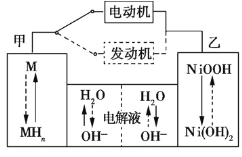
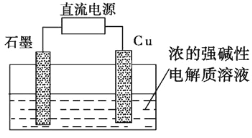
图1 图2
(2)Cu2O是一种半导体材料,可通过如图2所示的电解装置制取,电解总反应式为2Cu+H2O![]() Cu2O+H2↑,阴极的电极反应式是________。用镍氢电池作为电源进行电解,当电池中有1 mol H2被消耗时,Cu2O的理论产量为___g。
Cu2O+H2↑,阴极的电极反应式是________。用镍氢电池作为电源进行电解,当电池中有1 mol H2被消耗时,Cu2O的理论产量为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,Ksp(BaCO3)=8.1×10-9,Ksp(BaSO4)=1.0×10-10,下列说法正确的是( )
A.因为Ksp(BaCO3)>Ksp(BaSO4),所以BaSO4不能转化成BaCO3
B.25℃时,BaCO3要在Na2SO4溶液中开始转化成BaSO4,则Na2SO4的浓度必须不低于1.1×10-6mol·L-1
C.在20mL0.002mol·L-1的Na2SO4溶液中加入20mL0.002mol·L-1的BaCl2溶液,无BaSO4沉淀生成
D.向含有等浓度、等体积的BaCl2溶液的两支试管中同时滴加等浓度的Na2CO3和Na2SO4溶液,先生成BaCO3沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A.杜康用高粱酿酒的原理是通过蒸馏法将高粱中的乙醇分离出来
B.聚合物![]() 不是纯净物
不是纯净物
C.相对分子质量为72的某烷烃,一氯代物有4种
D.植物油氢化、塑料和橡胶的老化过程中均发生了加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下按如图安装好实验装置,在锥形瓶内盛6.5 g锌粒(颗粒大小基本相同),通过分液漏斗加入40 mL 2.5 mol/L的硫酸溶液,将产生的H2收集在一个注射器中,用时10 s时恰好收集到气体的体积为50 mL(若折合成0 ℃、101 kPa条件下的H2体积为44.8 mL),在该温度下,下列说法不正确的是( )
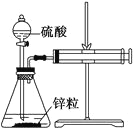
A. 用锌粒来表示10 s内该反应的速率为0.013 g/s
B. 忽略锥形瓶内溶液体积的变化,用H+来表示10 s内该反应的速率为0.01 mol/(L·s)
C. 忽略锥形瓶内溶液体积的变化,用Zn2+来表示10 s内该反应的速率为0.01 mol/(L·s)
D. 用H2来表示10 s内该反应的速率为0.000 2 mol/s
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com