
【题目】以下六种物质是一个氧化还原反应的反应物和生成物:NO、FeSO4、H2O、Fe(NO3)3、HNO3和Fe2(SO4)3. 写出该反应方程式并配平,用单线桥标出电子转移方向与数目。____________________ ,该反应中,氧化剂是___________,被氧化的元素是___________,若产生标准状况下11.2L气体,转移电子数为____________。
【答案】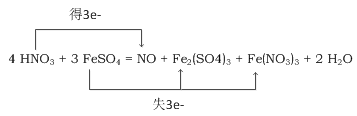 HNO3 Fe 1.5NA
HNO3 Fe 1.5NA
【解析】
根据氧化还原反应的基本规律,HNO3具有强氧化性,应该为反应物,则NO为生成物,反应中硝酸被还原,为氧化剂,则反应中FeSO4应为还原剂,被还原为Fe2(SO4)3和Fe(NO3)3,据此答题。
氧化还原反应的特征为化合价的升降,反应中HNO3为反应物,具有强氧化性,则NO为生成物,反应中硝酸被还原,为氧化剂,题给物质中元素化合价发生变化的还有Fe,则Fe元素化合价应升高,被氧化,则FeSO4应为还原剂,被氧化生成Fe2(SO4)3和Fe(NO3)3,根据电子守恒,氮元素的化合价降低了3价,铁元素化合价升高了1价,根据得失电子守恒以及元素守恒,所以硫酸亚铁前边系数是3,硝酸前系数是4,水的前边系数是2,反应方程式为:4HNO3+3FeSO4=Fe2(SO4)3+Fe(NO3)3+NO↑+2H2O,用单线桥标出电子转移方向与数目为: ,NO的物质的量是11.2L÷22.4L/mol=0.5mol,反应中氮元素的化合价从+5价降低到+2价,得到3个电子,因此反应中转移电子的个数是1.5NA,故答案为:
,NO的物质的量是11.2L÷22.4L/mol=0.5mol,反应中氮元素的化合价从+5价降低到+2价,得到3个电子,因此反应中转移电子的个数是1.5NA,故答案为:
 ,HNO3,Fe,1.5NA。
,HNO3,Fe,1.5NA。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】工业上利用废镍催化剂(主要成分为Ni,还含有一定量的Zn、Fe、SiO2、CaO等)制备草酸镍晶体的流程如下:
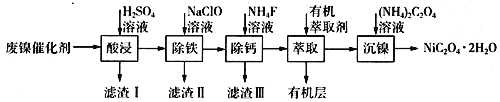
(1)请写出一种能提高“酸浸”速率的措施:________________________;滤渣I的成分是____________(填化学式)。
(2)除铁时,控制不同的条件可以得到不同的滤渣II。已知滤渣II的成分与温度、pH的关系如图所示:
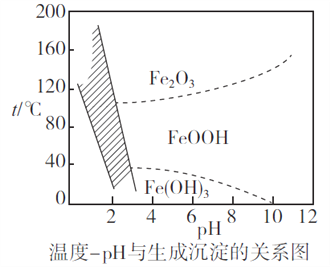
①若控制温度40℃、pH=8,则滤渣II的主要成分为_________________________(填化学式)。
②若控制温度80℃、pH=2,可得到黄铁矾钠[Na2Fe6(SO4)4(OH)12](图中阴影部分),写出生成黄铁矾钠的离子方程式:___________________________________________。
(3)已知除铁后所得100 mL溶液中c(Ca2+)=0.01mol·L-1,加入100 mL NH4F溶液,使Ca2+恰好沉淀完全即溶液中c(Ca2+)=1×10-5 mol·L-1,则所加c(NH4F)=_________mol·L-1。[已知Ksp(CaF2)=5.29×10-9]
(4)加入有机萃取剂的作用是________________________。
(5)某化学镀镍试剂的化学式为MxNi(SO4)y(M为+1价阳离子,Ni为+2价,x、y均为正整数)。为测定该镀镍试剂的组成,进行如下实验:
I.称量28.7g镀镍试剂,配制100 mL溶液A;
Ⅱ.准确量取10.00 mL溶液A,用0.40 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+),消耗EDTA标准溶液25.00mL;
Ⅲ.另取10.00 mL溶液A,加入足量的BaCl2溶液,得到白色沉淀4.66g。
①配制100 mL镀镍试剂时,需要的仪器除药匙、托盘天平、玻璃棒、烧杯、量筒、胶头滴管外,还需要________________________。
②该镀镍试剂的化学式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是 ( )
A. 盐酸溶液加到氢氧化铁中:Fe(OH)3+3H+===Fe3++3H2O
B. 硫酸与氢氧化钡溶液反应:H++SO![]() +Ba2++OH-===BaSO4↓+H2O
+Ba2++OH-===BaSO4↓+H2O
C. CuSO4溶液与氨水反应:Cu2++2NH3·H2O===Cu(OH)2↓+2NH。
D. 少量CO2通入澄清石灰水中:CO2+Ca2++2OH-===CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金、银、铜、铁、铝和钛均是人类大量生产和使用的金属。试回答与上述金属原子结构有关的问题:
(1)上述金属中属于主族元素的有________。
(2)钛被称为继铁、铝之后的第三金属。基态钛原子外围电子的电子排布图为_____________。
(3)基态金原子的外围电子排布式为5d106s1,试判断金在元素周期表中位于第_____周期第____族。
(4)已知Ag与Cu位于同一族,则Ag在元素周期表中位于________区(填“s”、“p”、“d”、“f”或“ds”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氨可以与热的氧化铜反应得到N2和金属铜,用如图中的装置可以实现该反应(夹持装置略去)。回答下列问题:
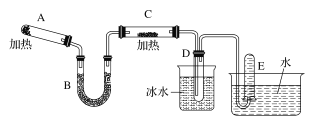
(1)A中发生反应的化学方程式是_____________。
(2)B中加入的物质是________。
(3)实验时在C中观察到的现象是________,发生反应的化学方程式是_______。
(4)检验D中收集到的物质的方法和现象是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与人类生产、生活密切相关。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:CO(g)+NO2(g)=NO(g)+CO2(g) △H=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-b kJ·mol-1(b>0)
若用CO还原NO2至N2,当消耗标准状况下3.36L CO时,放出的热量为___________kJ(用含有a和b的代数式表示)。
(2)在373K时,向体积为2L的恒容真空容器中通入0.40 mol NO2,发生反应:2NO2(g)![]() N2O4(g) △H=-57.0 kJ·mol-1。测得NO2的体积分数[
N2O4(g) △H=-57.0 kJ·mol-1。测得NO2的体积分数[![]() (NO2)]与反应时间(t)的关系如下表:
(NO2)]与反应时间(t)的关系如下表:

①0~20 min内,v(N2O4)=________mol·L-1·min-1。
②上述反应中,v(NO2)=k1·c2(NO2),v(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时,k1、k2的数学关系式为_____________。改变温度至T1时k1=k2,则T1_________373K(填“>”、“<”或“=”)。
(3)连二次硝酸(H2N2O2)是一种二元弱酸。25℃时,向100 mL 0.1 mol·L-1H2N2O2溶液中加入V mL 0.1mol·L-1 NaOH溶液。(已知25℃时,连二次硝酸的Ka1=10-7,Ka2=10-12)
①若V=100,则所得溶液中c(H2N2O2)_____________c(N2O22-) (填“>”、“<”或“=”),通过计算解释原因____________________________________________________________。
②若V=200,则所得溶液中离子浓度由大到小的顺序为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前段时间“伊核协议”再次成为国际热点。国际上不提倡伊朗浓缩铀,是因为铀-235(23592U)是制造原子弹的原料,23592U原子核内含有的中子数为
A. 92B. 235C. 143D. 327
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL 6mol/L硫酸溶液与过量锌粒反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可采取的措施是( )
A.加入少量碳酸钠粉末
B.加入少量硫酸铜溶液
C.加入适量NaCl溶液
D.加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com