
【题目】金、银、铜、铁、铝和钛均是人类大量生产和使用的金属。试回答与上述金属原子结构有关的问题:
(1)上述金属中属于主族元素的有________。
(2)钛被称为继铁、铝之后的第三金属。基态钛原子外围电子的电子排布图为_____________。
(3)基态金原子的外围电子排布式为5d106s1,试判断金在元素周期表中位于第_____周期第____族。
(4)已知Ag与Cu位于同一族,则Ag在元素周期表中位于________区(填“s”、“p”、“d”、“f”或“ds”)。
【答案】 铝 ![]() 六 ⅠB ds
六 ⅠB ds
【解析】
(1)铝位于第三周期第ⅢA族,属于主族元素,金、银、铜、铁、和钛都不属于主族元素,
因此,本题正确答案是:铝。
(2)钛基态原子核外电子排布式为![]() ,其外围电子排布式为
,其外围电子排布式为![]() ,则其外围电子的电子排布图为:
,则其外围电子的电子排布图为:![]() ,
,
因此,本题正确答案是:![]() 。
。
(3)电子排布式中最大能层数与周期数相等,外围电子排布式为![]() 的原子位于第IB族,基态金原子的外围电子排布式为
的原子位于第IB族,基态金原子的外围电子排布式为![]() ,该原子最大能层数是6,所以金原子位于第6周期第ⅠB族,因此,本题正确答案是:6;ⅠB。
,该原子最大能层数是6,所以金原子位于第6周期第ⅠB族,因此,本题正确答案是:6;ⅠB。
(4)ⅠA、ⅡA族最后填充s电子,为s区;ⅢA~零族为p区,第ⅢB~ⅤⅡB族和第ⅤⅢ为d区;ⅠB和ⅡB族为ds区,Ag与Cu位于同一族,属于第ⅠB族,所以属于ds区,因此,本题正确答案是:ds。
点睛:(1)铝属于主族元素;(2)钛基态原子核外电子排布式为![]() ,其外围电子排布式为
,其外围电子排布式为![]() ;(3)电子排布式中能层数与周期数相等,外围电子排布式为
;(3)电子排布式中能层数与周期数相等,外围电子排布式为![]() 的原子位于第IB族;(4)ⅠA、ⅡA族最后填充s电子,为s区;ⅢA~零族为p区,第ⅢB~ⅤⅡB族和第ⅤⅢ为d区;ⅠB和ⅡB族为ds区。
的原子位于第IB族;(4)ⅠA、ⅡA族最后填充s电子,为s区;ⅢA~零族为p区,第ⅢB~ⅤⅡB族和第ⅤⅢ为d区;ⅠB和ⅡB族为ds区。


科目:高中化学 来源: 题型:
【题目】研究氮及其化合物的性质,可以有效改善人类的生存环境。氮元素化合价一物质类别关系图如下。
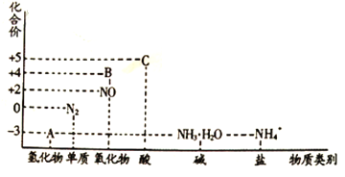
回答下列问题:
(1)在催化剂和加热的条件下,物质A生成NO是工业制硝酸的重要反应,化学方程式是_______________________________________________________________________________。
(2)在加热条件下,物质C的浓溶液与碳单质反应,写出反应的化学方程式______________。
(3)实验室中,检验溶液中含有NH4+的操作方法是______________。
(4)物质B为红棕色气体,写出该物质与水反应的离子方程式______________________,当反应消耗3.36L(标准状况)物质B时,转移电子的物质的量为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,将a mol CO2气体通入1L bmol/L的NaOH溶液中,下列对所得溶液的描述不正确的是
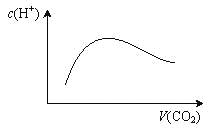
A. 当a=2b时,随着CO2气体的通入,溶液中由水电离出的c(H+)有如上图变化关系
B. 当a=b时,所得溶液中存在:c(OH-)+c(CO32-)=c(H+)+c(H2CO3)
C. 当2a=b时,所得溶液中存在:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
D. 当1/2<a/b<1时,所得溶液中一定存在:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同主族的A、B两元素,已知A的原子序数为x,A和B所在周期包含元素的种数分别为m和n,如果A和B在第ⅠA族,当B在A的上一周期时,B的原子序数为________;当B在A的下一周期时,B的原子序数为________;如果A和B在第ⅦA族,当B在A的上一周期时,B的原子序数为________;当B在A的下一周期时,B的原子序数为________。
(2)已知R为ⅡA族元素,L为ⅢA族元素,它们的原子序数分别为m和n,且R、L为同一周期元素,下列关系式错误的是(____)
A.n=m+1 B.n=m+10 C.n=m+11 D.n=m+25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿石的主要成分为FeS2和少量FeS(假设其它杂质中不含铁、硫元素,且高温下不发生化学变化),它是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为4FeS2+11O2=2Fe2O3+8SO2,4FeS+7O2=2Fe2O3+4SO2
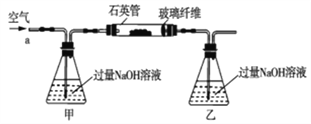
(实验一)测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:
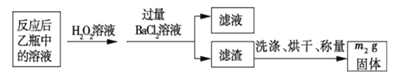
(1)鼓入空气的作用是_____________________。
(2)反应结束后,给乙瓶溶液中加入足量H2O2溶液的目的是___________(用化学方程式表示)。H2O2可以看成是一种很弱的酸,写出其主要的电离方程式为____________________。
(3)该黄铁砂石中硫元素的质量分数为____________________(列出表达式即可)。
(实验二)测定铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤 ③将过滤液稀释至250mL
④取25.00mL稀释液,用0.100mol·L-1的酸性KMnO4溶液滴定
(4)步骤②中,若用铁粉作还原剂,则所测得的铁元素的含量__________(填“偏大”“ 偏小” 或“无影响”)。
(5)请写出步骤②中洗涤的方法____________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
第一次 | 第二次 | 第三次 | 第四次 | |
消耗KMnO4溶液体积/ml | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度c(Fe2+)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下六种物质是一个氧化还原反应的反应物和生成物:NO、FeSO4、H2O、Fe(NO3)3、HNO3和Fe2(SO4)3. 写出该反应方程式并配平,用单线桥标出电子转移方向与数目。____________________ ,该反应中,氧化剂是___________,被氧化的元素是___________,若产生标准状况下11.2L气体,转移电子数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组将SO2通入Na2S和Na2SO3的混合溶液中制备硫代硫酸钠(Na2S2O3)。其装置如下图所示(省略夹持装置),下列说法错误的是
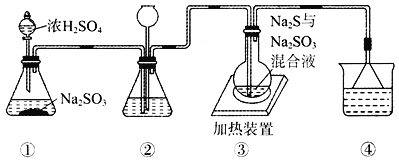
A. 装置②的作用之一是观察SO2的生成速率,其中的液体可以是饱和NaHSO3溶液
B. 为提高产品纯度,使烧瓶中Na2S和Na2SO3恰好完全反应,则![]()
C. 装置④的作用是吸收尾气,同时防止倒吸
D. 装置①也可用于高锰酸钾与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入一块生铁块,放置一段时间。下列有关描述正确的是
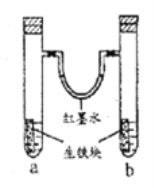
A. 生铁块中的碳是原电池的负极
B. 红墨水柱两边的液面变为左低右高
C. 两试管中相同的电极反应式是:Fe-2e-=Fe2+
D. a试管中发生了析氢腐蚀,b试管中发生了吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法正确的是( )
A.能生成碱的金属元素都在ⅠA族
B.稀有气体元素原子的最外层电子数均为8
C.第二周期ⅣA族元素的原子核电荷数和种子数一定为6
D.原子序数为14的元素位于元素周期表的第3周期ⅣA族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com