
(14分)硫化物在自然界中的部分循环关系如下。

(1)H2S在空气中可以燃烧。
已知: 2H2S(g) + O2(g)  2S(s) + 2H2O(g) ΔH= -442.38 kJ/mol ①
2S(s) + 2H2O(g) ΔH= -442.38 kJ/mol ①
S(s) + O2(g)  SO2(g) ΔH= -297.04 kJ/mol ②
SO2(g) ΔH= -297.04 kJ/mol ②
H2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是 。
(2)SO2是大气污染物,海水具有良好的吸收SO2的能力,其过程如下。
① SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32—,其电离方程式是 。
② SO32—可以被海水中的溶解氧氧化为SO42—。海水的pH会 (填“升高” 、“不变”或“降低”)。
③ 为调整海水的pH,可加入新鲜的海水,使其中的HCO3—参与反应,其反应的离子方程式是 。
④ 在上述反应的同时需要大量鼓入空气,其原因是 。
(3)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS),用化学用语表示由ZnS转变为CuS的过程: 。
(4)SO2和O2在H2SO4溶液中可以构成原电池,其负极反应式是 。
(14分,每空2分)
(1)2H2S(g)+3O2(g)  2SO2(g)+2H2O(g) ΔH= -1036.46 kJ/mol (方程式和计算各1分)
2SO2(g)+2H2O(g) ΔH= -1036.46 kJ/mol (方程式和计算各1分)
(2)① H2SO3 HSO3—+ H+ HSO3—
HSO3—+ H+ HSO3— SO3 2—+ H+ (每个1分)
SO3 2—+ H+ (每个1分)
② 降低
③ HCO3 —+ H+  CO2 ↑+ H2O(物质1分,配平1分)
CO2 ↑+ H2O(物质1分,配平1分)
④提高脱硫海水的溶解氧,将SO32-氧化成为SO42-,有利于平衡H2SO3 HSO3—+ H+ HSO3—
HSO3—+ H+ HSO3— SO3 2—+ H+ 正向移动(1分),提高二氧化硫的转化率,同时起到加快反应速率的作用(1分)。
SO3 2—+ H+ 正向移动(1分),提高二氧化硫的转化率,同时起到加快反应速率的作用(1分)。
(3)
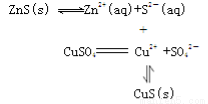
(4)负极:SO2 - 2e—+ 2H2O  SO4 2—+ 4H+(物质1分,配平1分)
SO4 2—+ 4H+(物质1分,配平1分)
【解析】
试题分析:(1)根据盖斯定律得目标方程式=①+2×②,所以H2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是2H2S(g)+3O2(g)  2SO2(g)+2H2O(g) ΔH= -1036.46 kJ/mol
2SO2(g)+2H2O(g) ΔH= -1036.46 kJ/mol
(2)①亚硫酸是弱酸,分步电离得SO3 2—,电离方程式是H2SO3 HSO3—+ H+ HSO3—
HSO3—+ H+ HSO3— SO3 2—+ H+
SO3 2—+ H+
②SO32—可以被海水中的溶解氧氧化为SO42—,硫酸是强酸,溶液中的氢离子浓度增大,pH降低;
③新鲜的海水显酸性,与HCO3—反应生成二氧化碳和水,离子方程式为HCO3 —+ H+  CO2 ↑+ H2O
CO2 ↑+ H2O
④海水具有良好的吸收SO2的能力,大量鼓入空气,可以提高海水中的含氧量,将SO32-氧化成为SO42-,有利于平衡H2SO3 HSO3—+ H+ HSO3—
HSO3—+ H+ HSO3— SO3 2—+ H+ 正向移动,提高二氧化硫的转化率,同时起到加快反应速率的作用;
SO3 2—+ H+ 正向移动,提高二氧化硫的转化率,同时起到加快反应速率的作用;
(3)CuS比ZnS更难溶,硫化锌存在ZnS(s)  Zn2+(aq)+S2-(aq)平衡,当遇到硫酸铜溶液时,S2-与Cu2+结合生成CuS沉淀,使溶解平衡正向移动,最终ZnS全部转化为CuS,用化学用语表示为
Zn2+(aq)+S2-(aq)平衡,当遇到硫酸铜溶液时,S2-与Cu2+结合生成CuS沉淀,使溶解平衡正向移动,最终ZnS全部转化为CuS,用化学用语表示为
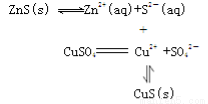
(4)负极发生氧化反应,元素化合价升高,所以是二氧化硫在负极发生反应,生成硫酸根离子,电极反应式为SO2 - 2e—+ 2H2O  SO4 2—+ 4H+
SO4 2—+ 4H+
考点:考查盖斯定律的应用,电离方程式的书写,溶解平衡的移动,电化学原理的应用


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源:2013-2014北京市大兴区高三统一练习理综化学试卷(解析版) 题型:实验题
(12分)天然水是人类饮用水的主要来源。从天然水获得可以饮用的水一般须经过沉降悬浮物、杀菌消毒等步骤。
(1)沉降悬浮物要在水中加入絮凝剂,如将铝盐加入水中能达到净水目的,
原因是 (用离子方程式表示)。
(2)氯气可用于自来水杀菌消毒剂,结合离子方程式和文字理由 。
(3)新型水处理剂高铁酸钾 (K2FeO4)具有强的氧化作用和絮凝作用。工业上可通过以下流程制备高铁酸钾:
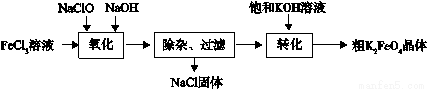
查阅资料:高铁酸盐在中性或酸性溶液中会逐渐分解,在碱性溶液中稳定。
完成“氧化”过程中的离子方程式
□Fe3+ + □ClO- +□ =□ FeO42- + □Cl- + □
“转化”过程中实现由Na2FeO4制得K2FeO4,是利用二者 性的不同。
③结合资料完成粗K2FeO4晶体的提纯:将粗产品用 溶解,然后再加入饱和KOH溶液、冷却结晶、过滤。
④高铁酸钾的应用还在不断扩展中。如可制成高铁电池, 电池反应为:
3Zn + 2K2FeO4 + 8H2O  3Zn(OH)2 + 2Fe(OH)3 + 4KOH
3Zn(OH)2 + 2Fe(OH)3 + 4KOH
放电时,正极反应为: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市大兴区高三统一练习理综化学试卷(解析版) 题型:选择题
下列解释事实的化学用语正确的是
A.CO2的水溶液显酸性: H2CO3  2H++CO32-
2H++CO32-
B.电子式表示氯化氢气的形成过程:
C.AlCl3溶液中加入过量氨水:Al3++4NH3?H2O = AlO2-+ 4NH4++2H2O
D.向K2Cr2O7溶液中滴加少量浓H2SO4,溶液橙色加深:
Cr2O72-(橙色) + H2O  2CrO42-(黄色) +2H+
2CrO42-(黄色) +2H+
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市丰台区高三二模理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.蛋白质及其水解产物都具有两性
B.淀粉和油脂都是可水解的高分子化合物
C.鸡蛋清溶液中加入饱和Na2SO4溶液有沉淀生成是因为蛋白质变性
D.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市东城区高三第二学期综合练习二理综化学试卷(解析版) 题型:简答题
(16分)有机物5一甲基 是一种医药合成中间体,某同学设计它的合成路线如下:
是一种医药合成中间体,某同学设计它的合成路线如下:

(1)①的反应类型是 。
(2)E的结构简式是 。
(3)A的结构简式是 ;③的反应条件和所需无机试剂是 。
(4)下列有关5一甲基茚( )的说法正确的是 (填序号)。
)的说法正确的是 (填序号)。
A.一定条件下能与卤素单质发生取代反应
B.1 mol该物质最多与4 mol H2发生加成反应
C.一定条件下能发生加聚反应生成高分子化合物
D.与溴的四氯化碳溶液反应得到的产物不能使高锰酸钾酸性溶液褪色
(5)反应⑧的化学方程式是 。
(6)满足下列条件的G的同分异构体有 种;写出其中一种的结构简式 。
①分子中含有苯环且苯环上只有一个取代基;②能发生银镜反应。
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市东城区高三二模理综化学试卷(解析版) 题型:选择题
下图是制备和研究乙炔的性质实验装置图。下列说法不正确的是

A. 制备乙炔的反应原理是CaC2+2H2O  Ca(OH) 2+C2H2↑
Ca(OH) 2+C2H2↑
B. c的作用是除去影响后续实验的杂质
C. d中的有机产物与AgNO3溶液混合能产生沉淀
D. e中的现象说明乙炔能被高锰酸钾酸性溶液氧化
查看答案和解析>>
科目:高中化学 来源:2013-2014内蒙古赤峰市年宁城县高三5月模拟考试理综化学试卷(解析版) 题型:选择题
下图是一种燃料型电池检测仪的工作原理示意图。下列说法不正确的是 ( )

A.该仪器工作时酒精浓度越大,则电流强度越大
B.工作时处电路电子流向为X→Y
C.检测结束后,X极区的pH增大
D.电池总反应为2CH3CH2OH+O2=2CH3CHO+2H2O
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com