
【题目】合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH<0。反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
CO2(g)+H2(g) ΔH<0。反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
A.增大CO的浓度B.降低温度C.升高温度D.增大压强
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,将amol氮气与bmol氢气的混合气体通入一个固定容积的密闭容器中,发生反应N2(g)+3H2(g) ![]() 2NH3(g)。
2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,则a值为________。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中氨气体积分数为25%,平衡时氨气的物质的量为________。
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同)n始∶n平=______。
(4)原气体中a∶b=________。
(5)达到平衡时混合气体中,n(N2)∶n(H2)∶n(NH3)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向10 mL 0.10molL1-1YOH溶液中逐渐滴加0.20molL-1HX 溶液,混合溶液的pH 变化如图所示(温度和体积变化忽硌不计)。下列结论错误的是
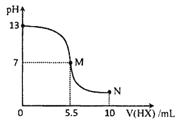
A.HX为一元弱酸,YOH 为一元强碱
B.M点对应溶液中水的电离程度大于N 点溶液中水的电离程度
C.N点对应溶液中粒子浓度:c(HX)> c(X - ) > c(Y+ ) > c(H+ ) > c(OH-)
D.室温时,pH = a 的YX溶液中水电离出的c(OH-)=l.0×10-(14-a)molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下列8种化学符号:![]() O2、
O2、![]() O3、
O3、![]() H、
H、![]() C、
C、![]() Na、
Na、![]() N、
N、![]() C、
C、![]() Mg。
Mg。
(1)表示核素的符号共_____种。
(2)互为同位素的是______,质量数相等的是_______,中子数相等的是____。
(3)质量相同的H216O和D216O所含中子数之比为________。
Ⅱ.根据周期表对角线规则,金属Be与Al的单质及其化合物的性质相似。试回答下列问题:
(4)写出Be与NaOH溶液反应生成Na2[Be(OH)4]的离子方程式____________
(5)Be(OH)2与Mg(OH)2可用_________鉴别。
Ⅲ.铜有两种天然同位素 ![]() Cu和
Cu和![]() Cu,参考铜的相对原子质量(63.5)。
Cu,参考铜的相对原子质量(63.5)。
(6)计算![]() Cu的质量百分含量约是_________。(保留3位有效数字)
Cu的质量百分含量约是_________。(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组为了验证元素非金属性递变规律,设计了如下图所示的两套实验方案进行实验探究:
方案一 方案二
方案二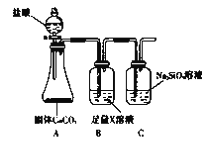
(1)根据方案一装置回答以下问题:
Ⅰ.写出装置①发生的化学反应方程式:_________________。
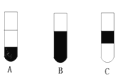
Ⅱ.若将反应后②中的溶液倒入CCl4中,出现的现象与下图吻合的是________。(填代号)
Ⅲ.装置③中的现象是____________________。
(2)根据方案二装置回答以下问题:
Ⅰ.方案二验证元素非金属性递变的理论依据是:__________________________。
Ⅱ.B装置的作用是_________________,X是_______________________。
Ⅲ.能说明碳元素和硅元素非金属性强弱的实验现象是______________________。
(3)方案一、二中多次用到广口瓶,在化学实验中广口瓶可以配合玻璃管和其他简单仪器组成各种功能的装置,被称为气体实验的“万能瓶”。分析下图中广口瓶组合装置的用途;
A____________;B_____________;C____________。
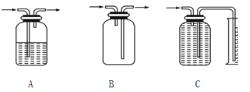
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )
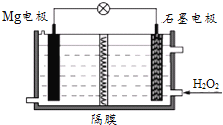
A.Mg电极是该电池的正极
B.溶液中的Cl-向正极移动
C.H2O2在石墨电极上发生氧化反应
D.石墨电极附近溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用来表示物质变化的化学用语正确的是( )
A.碳酸的电离方程式:H2CO3 ![]() CO32-+2 H+
CO32-+2 H+
B.硫酸钡的电离方程式:BaSO4 ![]() Ba2++SO42-
Ba2++SO42-
C.氢气燃烧的热化学方程式:H2(g)+![]() O2(g)=H2O(l)ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l)ΔH=-285.8 kJ·mol-1
D.C不完全燃烧的热化学方程式:C(s)+![]() O2 (g)=CO(g) △H = 110.5 kJ·mol-1
O2 (g)=CO(g) △H = 110.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸HX是一元弱酸,25℃时的电离平衡常数K a= 4.0×10—8。
(1)写出该酸的电离方程式_____________,其电离平衡常数表达式K a =_______。
(2)25℃时,向1 mol·L-1 HX 溶液中加入1 mol·L-1 盐酸,会________(“抑制”或“促进”)HX的电离,c(H+)____________(填“增大”、“减小”或“不变”), 电离平衡常数K a ________(填“增大”、“减小”或“不变”)。
(3)25℃时,若HX的起始浓度为0.01 mol·L-1,则平衡时c(H+)=_________mol/L, 由水电离的出的c(H+)=___________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年1月在武汉爆发了新型冠状病毒肺炎,引起了全世界人民的关注。瑞德西韦(remdesivir)是一种可能的特效药,其结构简式如图所示,下列说法不正确的是(磷酸酯与酯性质类似)( )
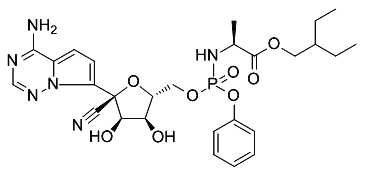
A.瑞德西韦的分子式是C27H32N6O8P
B.已知一个碳原子连接四个不同的原子(或基团)是具有手性的,瑞德西韦具有的手性碳原子有5个
C.若只考虑酯键的水解,瑞德西韦在水解后会成为4个分子
D.瑞德西韦的合成原料之一可能有苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com