
【题目】下列用来表示物质变化的化学用语正确的是( )
A.碳酸的电离方程式:H2CO3 ![]() CO32-+2 H+
CO32-+2 H+
B.硫酸钡的电离方程式:BaSO4 ![]() Ba2++SO42-
Ba2++SO42-
C.氢气燃烧的热化学方程式:H2(g)+![]() O2(g)=H2O(l)ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l)ΔH=-285.8 kJ·mol-1
D.C不完全燃烧的热化学方程式:C(s)+![]() O2 (g)=CO(g) △H = 110.5 kJ·mol-1
O2 (g)=CO(g) △H = 110.5 kJ·mol-1
【答案】C
【解析】
A项、碳酸是二元弱酸,在溶液中分步电离,以一级为主,电离方程式:H2CO3![]() HCO3-+H+,故A错误;
HCO3-+H+,故A错误;
B项、硫酸钡为强电解质,溶于水的硫酸钡在溶液中完全电离,电离方程式为BaSO4=Ba2++SO42-,故B错误;
C项、1mol氢气在0.5mol氧气中完全燃烧生成液态水放出285.8 kJ热量,热化学方程式为H2(g)+![]() O2(g)=H2O(l)ΔH=-285.8 kJ·mol-1,故C正确;
O2(g)=H2O(l)ΔH=-285.8 kJ·mol-1,故C正确;
D项、1molC在0.5mol氧气中不完全燃烧生成一氧化碳放出110.5kJ热量,热化学方程式:C(s)+![]() O2 (g)=CO(g) △H =—110.5 kJ·mol-1,故D错误;
O2 (g)=CO(g) △H =—110.5 kJ·mol-1,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】一种以NH4Cl酸性蚀铜废液[含NH4Cl,Cu(NH3)4Cl2、CuCl、CuSO4及盐酸等]为原料制备CuCl并回收Cu(OH)2的工艺流程如图:
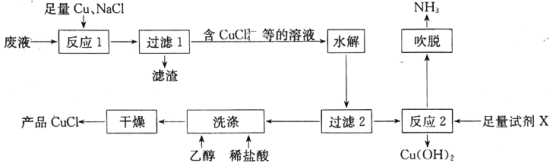
已知:CuCl溶于浓盐酸,难溶于水,不溶于乙醇。
回答下列问题:
(1)“反应1”中,NaCl、Cu与CuSO4反应的离子方程式为__;生产中常将“过滤1”的滤渣返回到“反应1”中,其目的是__。
(2)“水解”步骤中,溶液中的CuCl43-在加入大量水稀释即可析出CuCl,原因是__(结合离子方程式,从平衡角度分析)。
(3)湿的CuCl在空气中易被氧化为Cu2(OH)3Cl,该反应的化学方程式为__。
(4)“反应2”需加入的试剂X是__;“吹脱”出来的NH3可用于生产碳铵化肥,主要反应的化学方程式为__。
(5)测定产品中CuCl质量分数的步骤如下:称取ag产品,加入稍过量的FeCl3溶液,待溶解后用邻菲罗啉作指示剂,立刻用cmol·L-1的Ce(SO4)2标准溶液滴定到终点,消耗标准溶液VmL。则产品中CuCl的质量分数为__(已知滴定反应为Ce4++Fe2+=Ce3++Fe3+,列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )
A.升高温度,平衡正向移动,醋酸的电离常数Ka值增大
B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)增大
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.25℃时,欲使醋酸溶液pH、电离常数Ka和电离程度都减小,可加入少量冰醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH<0。反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
CO2(g)+H2(g) ΔH<0。反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
A.增大CO的浓度B.降低温度C.升高温度D.增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积固定的密闭容器中通入2.0 mol SO2、1.2molO2,发生反应2SO2(g) + O2(g)![]() 2SO3(g) ΔH= -198 kJ·mol - 1,下列判断不正确的是( )
2SO3(g) ΔH= -198 kJ·mol - 1,下列判断不正确的是( )
A.2SO2(g) + O2(g) ![]() 2SO3(s) ΔH< -198kJ·mol-1
2SO3(s) ΔH< -198kJ·mol-1
B.增加反应物的量不能改变上述反应的ΔH
C.充分反应后,放出的热量小于198 kJ
D.若从反应开始到建立平衡放出热量158.4 kJ,则SO2的平衡转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.32g碳酸钠、氢氧化钠的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如下图所示,下列说法中正确的是( )
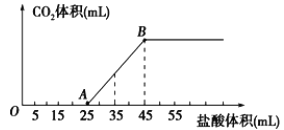
A.OA段发生反应的离子方程式为:H++OH-→H2O
B.B当加入35mL盐酸时,产生CO2的体积为224mL
C.A点溶液中的溶质为NaC1、Na2CO3
D.混合物中NaOH的质量0.60g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4kJ·mol-1。在密闭容器中,使2molN2和6molH2混合发生上述反应:
2NH3(g) ΔH=-92.4kJ·mol-1。在密闭容器中,使2molN2和6molH2混合发生上述反应:
(1)当反应达到平衡时,N2和H2的浓度比是____;N2和H2的转化率比是____。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量___________,密度______。(填“变大”“变小”或“不变”)。
(3)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将_____(填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度_____(填“大于”“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为______,3d能级上的未成对电子数为_______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是________。
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是______。
③氨的沸点_______(填“高于”或“低于”)膦(PH3),原因是_______;氨是______分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)铜晶体铜碳原子的堆积方式如图所示。
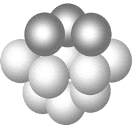
①基态铜在元素周期表中位置__________________。
②每个铜原子周围距离最近的铜原子数目_________。
(4)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如图所示(黑点代表铜原子)。
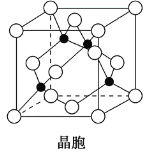
①该晶体的化学式为__________________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于________(填“离子”或“共价”)化合物。
③已知该晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为________pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在加入铝粉能放出氢气的无色溶液中,分别加入下列各组离子,可能大量共存的是
A.Ca2+、![]() 、
、![]() 、Na+B.Na+、Mg2+、
、Na+B.Na+、Mg2+、![]()
C.![]() 、Cu2+、K+、ClˉD.
、Cu2+、K+、ClˉD.![]() 、K+、Ba2+、OHˉ
、K+、Ba2+、OHˉ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com