
【题目】一定条件下,在体积固定的密闭容器中通入2.0 mol SO2、1.2molO2,发生反应2SO2(g) + O2(g)![]() 2SO3(g) ΔH= -198 kJ·mol - 1,下列判断不正确的是( )
2SO3(g) ΔH= -198 kJ·mol - 1,下列判断不正确的是( )
A.2SO2(g) + O2(g) ![]() 2SO3(s) ΔH< -198kJ·mol-1
2SO3(s) ΔH< -198kJ·mol-1
B.增加反应物的量不能改变上述反应的ΔH
C.充分反应后,放出的热量小于198 kJ
D.若从反应开始到建立平衡放出热量158.4 kJ,则SO2的平衡转化率为60%
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 加入催化剂有利于氨的合成
D. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L容器中三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式和反应开始至2 min末Z的平均反应速率分别为( )

A. X+3Y![]() 2Z 0.1 mol/(L·min) B. 2X+Y
2Z 0.1 mol/(L·min) B. 2X+Y![]() 2Z 0.1 mol/(L·min)
2Z 0.1 mol/(L·min)
C. X+2Y![]() Z 0.05 mol/(L·min) D. 3X+Y
Z 0.05 mol/(L·min) D. 3X+Y![]() 2Z 0.05 mol/(L·min)
2Z 0.05 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组为了验证元素非金属性递变规律,设计了如下图所示的两套实验方案进行实验探究:
方案一 方案二
方案二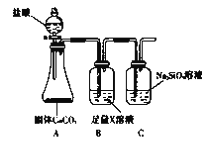
(1)根据方案一装置回答以下问题:
Ⅰ.写出装置①发生的化学反应方程式:_________________。
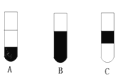
Ⅱ.若将反应后②中的溶液倒入CCl4中,出现的现象与下图吻合的是________。(填代号)
Ⅲ.装置③中的现象是____________________。
(2)根据方案二装置回答以下问题:
Ⅰ.方案二验证元素非金属性递变的理论依据是:__________________________。
Ⅱ.B装置的作用是_________________,X是_______________________。
Ⅲ.能说明碳元素和硅元素非金属性强弱的实验现象是______________________。
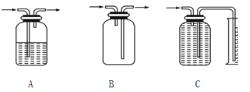
(3)方案一、二中多次用到广口瓶,在化学实验中广口瓶可以配合玻璃管和其他简单仪器组成各种功能的装置,被称为气体实验的“万能瓶”。分析下图中广口瓶组合装置的用途;
A____________;B_____________;C____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝试剂,其脱硝反应为:![]() ,该反应一定条件下可自发进行。若反应在恒容密闭容器中进行,下列由该反应作出的判断(有关图像)错误的是( )
,该反应一定条件下可自发进行。若反应在恒容密闭容器中进行,下列由该反应作出的判断(有关图像)错误的是( )
A.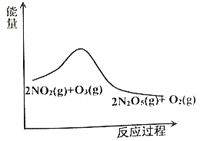 B.
B.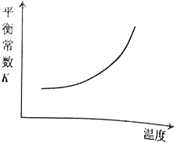
C.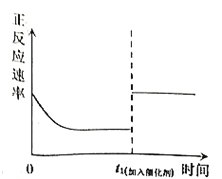 D.
D.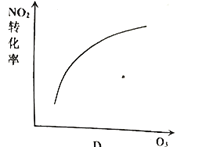
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用来表示物质变化的化学用语正确的是( )
A.碳酸的电离方程式:H2CO3 ![]() CO32-+2 H+
CO32-+2 H+
B.硫酸钡的电离方程式:BaSO4 ![]() Ba2++SO42-
Ba2++SO42-
C.氢气燃烧的热化学方程式:H2(g)+![]() O2(g)=H2O(l)ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l)ΔH=-285.8 kJ·mol-1
D.C不完全燃烧的热化学方程式:C(s)+![]() O2 (g)=CO(g) △H = 110.5 kJ·mol-1
O2 (g)=CO(g) △H = 110.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
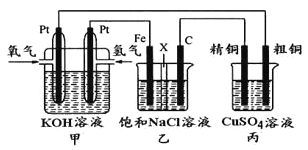
根据要求回答相关问题:
(1)甲装置中通入氧气的电极为______________(填“正极”或“负极”),负极的电极反应式为_________________。
(2)乙装置中铁电极为_______(填“阳极”或“阴极”),石墨电极(C)上发生_____反应(填“氧化”或“还原”),其电极反应式为___________________。
(3)反应一段时间后,乙装置中生成氢氧化钠主要在_____________区。(填“铁极”或“石墨极”)
(4)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将_______(填“增大”“减小”或“不变”)。
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为_____;丙装置中阴极析出铜的质量为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题:
(1)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。

组成M的元素中,电负性最大的是__________(填名称)。
(2)钛元素基态原子未成对电子数为________个,能量最高的电子占据的能级符号为________。
(3)①已知Al 的第一电离能为578 kJ·mol-1、第二电离能为1 817 kJ·mol-1、第三电离能为2 745 kJ·mol-1、第四电离能为11 575 kJ·mol-1。请解释其第二电离能增幅较大_______________________________。Al单质为面心立方晶体,其晶胞参数a=0.405 nm,晶胞中铝原子的配位数为________。
②第二电离能I(Cu)________(填“>”或“<”)I (Zn)。
(4)在硅酸盐中,SiO44—四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。
图(b)为一种无限长单链结构的多硅酸根(其中硅原子数为n):其中Si原子的杂化形式为_________,Si与O的原子数之比为__________,化学式为____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 铝粉投入到NaOH溶液中:2Al+2OH-+2H2O══ 2AlO2—+3H2↑
B. AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
C. 三氯化铁溶液中加入铁粉![]()
D. FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com