
【题目】将2.32g碳酸钠、氢氧化钠的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如下图所示,下列说法中正确的是( )
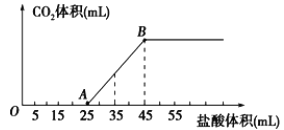
A.OA段发生反应的离子方程式为:H++OH-→H2O
B.B当加入35mL盐酸时,产生CO2的体积为224mL
C.A点溶液中的溶质为NaC1、Na2CO3
D.混合物中NaOH的质量0.60g
【答案】B
【解析】
A、根据图像,OA段没有二氧化碳气体放出,发生反应的离子方程式为:H++OH-═H2OCO32-+H+═HCO3-,故A错误;
B、AB段反应放出二氧化碳,发生反应的离子方程式为:HCO3-+H+=H2O+CO2↑,根据方程式n(CO2)=(35-25)×10-3L×1mol/L=0.01mol,所以二氧化碳的体积为:0.01mol×22.4L/mol=224mL,故B正确;
C、OA段发生反应的离子方程式为:H++OH-═H2OCO32-+H+═HCO3-,所以A点的溶质为NaC1、NaHCO3,故C错误;
D、由反应HCO3-+H+=H2O+CO2↑,n(CO2)=n(Na2CO3)=(45-25)×10-3×1=0.02mol,所以氢氧化钠的质量为2.32g-0.02×106g=0.2g,故D错误;
故选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】常温下,取0.1mol/L的NaA和NaB两种盐溶液各1L,分别通入0.02molCO2,发生如下反应:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3。在1LHA和HB的溶液分别加水稀释至体积为VL时可能有如图曲线,则下列说法正确的是( )
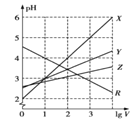
A.X是HA,Y是HB
B.常温下pH:NaA溶液>NaB溶液
C.若常温下,浓度均为0.1mol/L的NaA和HA的混合溶液pH>7,则c(A-)>c(HA)
D.在等浓度的NaA和NaB混合溶液中通入HCl至中性时,c(Cl-)=c(HA)+c(HB)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下列8种化学符号:![]() O2、
O2、![]() O3、
O3、![]() H、
H、![]() C、
C、![]() Na、
Na、![]() N、
N、![]() C、
C、![]() Mg。
Mg。
(1)表示核素的符号共_____种。
(2)互为同位素的是______,质量数相等的是_______,中子数相等的是____。
(3)质量相同的H216O和D216O所含中子数之比为________。
Ⅱ.根据周期表对角线规则,金属Be与Al的单质及其化合物的性质相似。试回答下列问题:
(4)写出Be与NaOH溶液反应生成Na2[Be(OH)4]的离子方程式____________
(5)Be(OH)2与Mg(OH)2可用_________鉴别。
Ⅲ.铜有两种天然同位素 ![]() Cu和
Cu和![]() Cu,参考铜的相对原子质量(63.5)。
Cu,参考铜的相对原子质量(63.5)。
(6)计算![]() Cu的质量百分含量约是_________。(保留3位有效数字)
Cu的质量百分含量约是_________。(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )
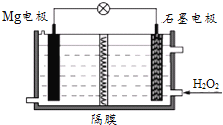
A.Mg电极是该电池的正极
B.溶液中的Cl-向正极移动
C.H2O2在石墨电极上发生氧化反应
D.石墨电极附近溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用来表示物质变化的化学用语正确的是( )
A.碳酸的电离方程式:H2CO3 ![]() CO32-+2 H+
CO32-+2 H+
B.硫酸钡的电离方程式:BaSO4 ![]() Ba2++SO42-
Ba2++SO42-
C.氢气燃烧的热化学方程式:H2(g)+![]() O2(g)=H2O(l)ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l)ΔH=-285.8 kJ·mol-1
D.C不完全燃烧的热化学方程式:C(s)+![]() O2 (g)=CO(g) △H = 110.5 kJ·mol-1
O2 (g)=CO(g) △H = 110.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取9.28g Na2CO3·x H2O溶于水配成5mL溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸20mL,并收集到896mL CO2(标准状况下)。求:
(1)稀盐酸的物质的量浓度;________
(2)x的值。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸HX是一元弱酸,25℃时的电离平衡常数K a= 4.0×10—8。
(1)写出该酸的电离方程式_____________,其电离平衡常数表达式K a =_______。
(2)25℃时,向1 mol·L-1 HX 溶液中加入1 mol·L-1 盐酸,会________(“抑制”或“促进”)HX的电离,c(H+)____________(填“增大”、“减小”或“不变”), 电离平衡常数K a ________(填“增大”、“减小”或“不变”)。
(3)25℃时,若HX的起始浓度为0.01 mol·L-1,则平衡时c(H+)=_________mol/L, 由水电离的出的c(H+)=___________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是典型的可充电电池,电池总反应式为:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。回答下列问题:
2PbSO4+2H2O。回答下列问题:
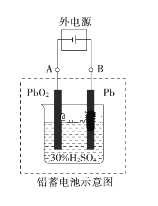
(1)放电时,负极为_______电极,试写出该电极的电极反应式是___________。电解液中H2SO4的浓度将变____________。(填“升高”、 “降低” 或“不变”)
(2)电池放电时,当外电路通过0.1 mol电子时,理论上负极板的质量增加________g,电池中消耗的硫酸物质的量为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,图甲是利用0.1mol/L的NaOH(aq)滴定三种等浓度等体积不同种一元弱酸的滴定曲线(实线),图乙是是利用NaOH(aq)滴定三种不同浓度的同种一元弱酸的滴定曲线(实线)。虚线是等浓度盐酸的滴定曲线。(已知pX=-lgX)下列说法不正确的是( )
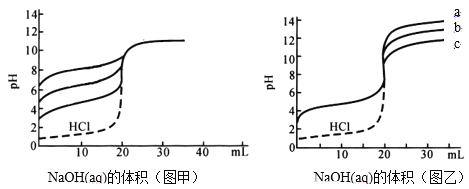
A.由图甲可以得出:一种酸的pKa越大,那么它的突跃范围越小
B.图甲滴定时可以使用酚酞(显色范围8.2-10.0)做指示剂,不可以用百里酚酞(显色范围10.0-10.6)
C.若图乙中的b曲线对应的浓度为0.1mol/L,已知其pKa=4.76。可以算出未滴定时,其pH=3.12
D.由图乙可以得出:三种一元弱酸浓度大小a>b>c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com