
【题目】在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述正确的是 ( )
CH3COO-+H+,对于该平衡,下列叙述正确的是 ( )
A.加入少量NaOH固体,平衡向正反应方向移动
B.加水,反应速率增大,平衡向逆反应方向移动
C.滴加少量0.1mol/L HCl溶液,溶液中c(H+)减少
D.加入少量CH3COONa固体,平衡向正反应方向移动
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO![]() 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/mol/L | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO)/mol/L | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H______0(填写“>”、“<”、“=”。
(2)前2s内的平均反应速率v(N2)=_____________。
(3)在该温度下,反应的平衡常数K=______________。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是_____。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验编号 | T/℃ | NO初始浓度mol/L | CO初始浓度mol/L | 催化剂的比表面积m2/g |
Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
Ⅱ | 124 | |||
Ⅲ | 350 | 124 |
①请在上表格中填入剩余的实验条件数据________________。
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是( )
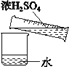
A.下列各项(①温度;②浓度;③容量;④刻度;⑤刻度线),其中容量瓶上标有①③④
B.用18.4 mol/L的硫酸配制1 mol/L稀硫酸的实验有如图所示的操作
C.容量瓶用蒸馏水洗净后要烘干以除去残留的水
D.若用含有Na2O的NaOH配制溶液,则所配溶液浓度偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有18.4 g由NaOH与NaHCO3组成的固体混合物,将它们在密闭容器中加热到250℃,经充分反应后排出气体,冷却,称得剩余固体的质量为16.6 g。试计算原混合物中NaOH的质量分数_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在化学工业中有诸多用途。请回答下列问题:
(1)硼氢化钠NaBH4是硼的重要化合物。
①NaBH4中B元素的化合价为______。
![]() 工业上可利用硼酸甲酯B(OCH3)3与氢化钠NaH反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为______。
工业上可利用硼酸甲酯B(OCH3)3与氢化钠NaH反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为______。
③NaBH4与水反应生成NaBO2和H2,该反应生成的氧化产物与还原产物的物质的量之比为______。
(2)工业上以铁硼矿![]() 主要成分为Mg2B2O5·H2O和Fe3O4,还有少量
主要成分为Mg2B2O5·H2O和Fe3O4,还有少量![]() 、FeO、CaO、
、FeO、CaO、![]() 和
和![]() 等
等![]() 为原料制备单质B的工艺流程如图所示:
为原料制备单质B的工艺流程如图所示:

已知:
金属离子 | Fe3+ | Al3+ |
开始沉淀的pH | 2.7 | 3.1 |
沉淀完全的pH | 3.7 | 4.9 |
![]() “浸出”时,将铁硼矿石粉碎的目的为______。
“浸出”时,将铁硼矿石粉碎的目的为______。
![]() 滤渣1的主要成分为______。
滤渣1的主要成分为______。
![]() “净化除杂”时需先加H2O2溶液,其目的为______,然后再调节溶液的pH≈5.0的目的是______。
“净化除杂”时需先加H2O2溶液,其目的为______,然后再调节溶液的pH≈5.0的目的是______。
![]() 制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将
制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将![]() 粗硼制成的BI3完全分解,生成的
粗硼制成的BI3完全分解,生成的![]() 用0.30mol·L-1Na2S2O3溶液滴定
用0.30mol·L-1Na2S2O3溶液滴定 至终点,消耗18.00mL Na2S2O3溶液。盛装Na2S2O3溶液应用______
至终点,消耗18.00mL Na2S2O3溶液。盛装Na2S2O3溶液应用______![]() 填“酸式”或“碱式”
填“酸式”或“碱式”![]() 滴定管,该粗硼样品的纯度为______。
滴定管,该粗硼样品的纯度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其中pH与溶液体积V的关系如图所示。下列说法正确的是( )
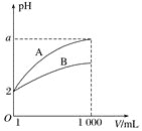
A.A、B两酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液的酸性强
C.a=5时,A是强酸,B是弱酸
D.一定有关系:5>a>2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,则:
①混合溶液中由水电离出的c(H+)________(填“>”、“<”或“=”)HCl溶液中由水电离出的c(H+)。
②求出混合溶液中下列算式的精确计算结果(填具体数字)。c(Cl-)-c(M+)=________ mol·L-1;c(H+)-c(MOH)=________ mol·L-1。
(2)有A、B、C、D四种一元酸溶液,对它们进行的有关实验及其结果分别为:①在物质的量浓度相同的A、C两溶液中,都滴加几滴甲基橙时,A溶液呈黄色,C溶液呈橙色,②B的钠盐溶液的pH值小于C的钠盐溶液pH值,③A酸与D的盐反应生成A的盐和D酸。由此可以确定这四种酸的酸性由强到弱的正确排列顺序为 ________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞液,在F极附近显红色.试回答以下问题:
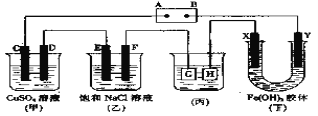
(1)电源A极的名称是_______。甲装置中电解反应的总化学方程式_____________________。
(2)如果收集乙装置中产生的气体,两种气体的体积比是______________。
(3)欲用丙装置给铜镀银,G应该是_______,电镀液的主要成分是_________(填化学式),G电极发生的反应是_____________________________。
(4)装置丁中的现象是__________________________,说明______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是
A.pH =1的H2SO4溶液中SO42-的数目为0.5NA
B.1 mol金刚石中C-C数目为4NA
C.12.0 g NaHSO4晶体中阴阳离子数目为0.3NA
D.2.3 g Na与过量O2反应转移电子数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com