
【题目】(1)常温下,0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,则:
①混合溶液中由水电离出的c(H+)________(填“>”、“<”或“=”)HCl溶液中由水电离出的c(H+)。
②求出混合溶液中下列算式的精确计算结果(填具体数字)。c(Cl-)-c(M+)=________ mol·L-1;c(H+)-c(MOH)=________ mol·L-1。
(2)有A、B、C、D四种一元酸溶液,对它们进行的有关实验及其结果分别为:①在物质的量浓度相同的A、C两溶液中,都滴加几滴甲基橙时,A溶液呈黄色,C溶液呈橙色,②B的钠盐溶液的pH值小于C的钠盐溶液pH值,③A酸与D的盐反应生成A的盐和D酸。由此可以确定这四种酸的酸性由强到弱的正确排列顺序为 ________ 。
【答案】> 9.9×10-7 1.0×10-8 B>C>A>D
【解析】
(1)①室温下取0.2 mol/L HCl溶液与0.2 mol/LMOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,溶液呈酸性,说明得到的盐是强酸弱碱盐,MOH为弱碱,含有弱根离子的盐促进水电离;
②根据电荷守恒得c(Cl-)-c(M+)=c(H+)-c(OH-)计算,质子守恒为c(H+)=c(MOH)+c(OH-),溶液pH=6,计算溶液中氢离子浓度和氢氧根离子浓度,再计算;
(2)甲基橙变色范围是3.1~4.4,根据A、C两种酸在甲基橙中的颜色判断二者酸性强弱;根据越弱越水解,pH越大,水解程度越大;根据强酸可以制弱酸进行比较A和D的酸性强弱。
(1)①等体积等浓度的盐酸和MOH恰好反应生成盐,得到的盐MCl溶液的pH=6,呈酸性,说明该盐是强酸弱碱盐,则MOH为弱碱,含有弱碱阳离子的盐促进水电离,M++H2OMOH+H+,酸抑制水电离,所以混合溶液中水电离出的c(H+)>0.2 mol/LHCl溶液中水电离出的c(H+),故答案为:>;
②混合溶液的pH=6,c(H+)=10-6 mol/L,离子积常数计算得到氢氧根离子浓度c(OH-)=![]() =10-8mol/L,根据电荷守恒得c(Cl-)-c(M+)=c(H+)-c(OH-)=10-6mol/L-10-8mol/L=9.9×10-7 mol/L,根据质子守恒得c(H+)-c(MOH)=c(OH-)=1.0×10-8 mol/L,故答案为:9.9×10-7;1.0×10-8;
=10-8mol/L,根据电荷守恒得c(Cl-)-c(M+)=c(H+)-c(OH-)=10-6mol/L-10-8mol/L=9.9×10-7 mol/L,根据质子守恒得c(H+)-c(MOH)=c(OH-)=1.0×10-8 mol/L,故答案为:9.9×10-7;1.0×10-8;
(2)①甲基橙是一种酸碱指示剂。根据甲基橙在不同pH时的变色情况可知,A溶液滴入甲基橙,溶液呈现黄色,说明A溶液pH大于4.4;C溶液呈现橙色,溶液pH在3.1~4.4之间,所以酸性C>A;②B的钠盐溶液的pH值小于C的钠盐溶液pH值,根据酸性越弱,水解程度越大,pH越大,所以酸性B>C;③A酸与D的盐反应生成A的盐和D酸,说明A的酸性大于D的酸性,即酸性A>D;根据以上分析可知,四种酸的酸性由强到弱的排列顺序为:B>C>A>D,故答案为:B>C>A>D。


科目:高中化学 来源: 题型:
【题目】(化学-物质结构与性质)
C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式 。
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ,微粒间存在的作用力是 。
(3)氧化物MO的电子总数与SiC的相等,则M为 (填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是 。
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成![]() 键和
键和![]() 键,SiO2中Si与O原子间不形成上述
键,SiO2中Si与O原子间不形成上述![]() 健。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述
健。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述![]() 键 。
键 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯吡格雷是一种用于抑制血小板聚集的药物,根据原料的不同,该药物的合成路线通常有两条,其中以2—氯苯甲醛为原料的合成路线如下:

(1)D→E所需X物质的结构简式:____________。
(2)C→D反应生成D的产量偏低,请解释原因:______________________________________(3)写出C聚合成高分子化合物的方程式___________________________________;
(4)A能转化成F分子C7H7NO2,写出同时符合下列条件F的所有同分异构体的结构简式:__________。
①红光光谱表明分子中含有-COO-结构;
②1H-NMR谱显示分子中含有苯环,且苯环上有三种不同化学环境的氢原子。
(5)已知:![]()
写出由乙烯、甲醇为有机原料制备化合物![]() 的合成路线流程图_____________________(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图_____________________(无机试剂任选)。合成路线流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述正确的是 ( )
CH3COO-+H+,对于该平衡,下列叙述正确的是 ( )
A.加入少量NaOH固体,平衡向正反应方向移动
B.加水,反应速率增大,平衡向逆反应方向移动
C.滴加少量0.1mol/L HCl溶液,溶液中c(H+)减少
D.加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一、(1)硫酸铜晶体的溶解度虽大,但溶解过程较慢,实验室常用热水配制以加快溶解速率,但常常会产生浑浊,请用文字简要说明原因_______________。
(2)稀Na2S溶液有一种腐卵气味,加入AlCl3溶液后,腐卵气味加剧,用离子方程式表示气味加剧过程所发生的化学反应______________。
二、依据氧化还原反应:MnO4-+5Fe2++8H+ = Mn2++5Fe3++4H2O,欲采用滴定的方法测定FeSO4的质量分数,实验步骤如下:①称量绿矾样品,配成100 mL待测溶液,②取一定体积待测液置于锥形瓶中,并加入一定量的硫酸,③将标准浓度的KMnO4溶液装入滴定管中,调节液面至a mL处,④滴定待测液至滴定终点时,滴定管的液面读数b mL,⑤重复滴定2~3次。
(1)如何知道滴定到达终点?__________。下列操作会导致测定结果偏低的是_______。
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失
(2)下列每种量器的数量不限,在上述实验中,必须使用的有____________;
A.托盘天平 B.量筒 C.碱式滴定管 D.酸式滴定管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)一定温度下,在容积固定的密闭容器中进行的可逆反应:2NO2![]() 2NO+O2,达到平衡的标志是
2NO+O2,达到平衡的标志是
①相同时间内,氧气的生成速率为n mol·L-1·s-1,NO2的生成速率为2n mol·L-1·s-1
②单位时间内生成n mol O2的同时生成2n mol的NO
③混合气体的颜色不再变化 ④混合气体的密度保持不变
⑤混合气体的平均相对分子质量不再改变 ⑥压强不随时间变化而变化
A. ①③⑤⑥ B. ②③⑤
C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,浓度都是1 mol·L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z。反应2 min后,测得参加反应的X2为0.6 mol·L-1,用Y2的变化表示的反应速率v(Y2)=0.1 mol·L-1· min-1,生成的c(Z)为0.4 mol·L-1,则该反应的化学方程式是( )
A.X2+2Y2![]() 2XY2B.3X2+Y2
2XY2B.3X2+Y2![]() 2X3Y
2X3Y
C.X2+3Y2![]() 2XY3D.2X2+Y2
2XY3D.2X2+Y2![]() 2X2Y
2X2Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是
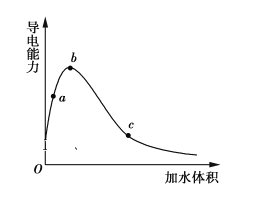
A.a、b、c三点溶液的pH:c<a<b
B.用湿润的pH试纸测量a处溶液的pH,测量结果偏小
C.a、b、c三点CH3COOH的电离程度:c<a<b
D.a、b、c三点溶液用1 mol·L1 NaOH溶液中和,消耗NaOH溶液体积:c<a<b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展做出巨大贡献的科学家,锂离子电池广泛应用于手机、笔记本电脑等。
(1)锂元素在元素周期表中的位置:_________________。
(2)氧化锂(Li2O)是制备锂离子电池的重要原料,氧化锂的电子式为_____________。
(3)近日华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出了石墨烯电池,电池反应式为LIxC6+Li1-x![]() C6+LiCoO2,其工作原理如图。
C6+LiCoO2,其工作原理如图。

①石墨烯的优点是提高电池的能量密度,石墨烯为层状结构,层与层之间存在的作用力是_______。
②锂离子电池不能用水溶液做离子导体的原因是___________(用离子方程式表示)。
③锂离子电池放电时正极的电极反应式为________________。
④请指出使用锂离子电池的注意问题____________________。(回答一条即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com