
【题目】为了解决目前存在的世界性能源危机,新的替代能源主要包括( )
①核能 ②柴草 ③焦碳 ④太阳能 ⑤氢能 ⑥液化石油气 ⑦水煤气 ⑧天然气
A. ①④⑤ B. ②③⑥⑦ C. ③⑥⑦⑧ D. ①②④
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
A. 放电时负极附近溶液的碱性不变
B. 充电过程是化学能转化为电能的过程
C. 充电时阳极反应:Ni(OH)2﹣e﹣+OH﹣═NiOOH+H2O
D. 放电时电解质溶液中的OH﹣向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水,稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4反应的化学方程式为:CuCl(s)+3HCl(aq)![]() H3CuCl4(aq)。
H3CuCl4(aq)。
Ⅰ.实验室用图所示装置制取CuCl,反应原理为:
2Cu2++SO2+8Cl+2H2O=2CuCl43+SO42+4H+
CuCl43(aq)![]() CuCl(s)+3Cl-(aq)
CuCl(s)+3Cl-(aq)

⑴装置A中分液漏斗中的试剂应该是____________。
A.稀硫酸 B.98%的硫酸 C.65%的硫酸
⑵装置B中反应结束后,取出混合物进行如下图所示操作,得到CuCl晶体。
![]()
操作ⅱ的主要目的是_______;操作ⅳ中宜选用的试剂是____________。
⑶实验室保存新制CuCl晶体的方法是___________________________。
⑷欲提纯某混有铜粉的CuCl晶体,请简述实验方案_______________。
Ⅱ.某同学利用如图所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成。

已知:①CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl·H2O。
②保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气。
(5)为了确保实验正确性,D、E、F、G测定气体顺序应该为________________。
(6)写出保险粉和KOH的混合溶液吸收O2的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5 mol H2O的质量为 ____,其中含有_____个水分子,共有____个原子。
(2)质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是______,在相同温度和相同压强条件下,体积最大的是______,体积最小的是________。
(3)在_______mL 0.2 mol/L NaOH溶液中含1 g溶质;配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O _________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 钠在空气中燃烧时,先熔化,再燃烧,发出黄色火焰,生成过氧化钠
B. 铝是地壳里含量最多的金属元素,在常温下,铝不能与氧气反应
C. 青铜是我国使用最早的合金,钢是用量最大、用途最广的合金
D. 铁在潮湿的空气中生成的氧化物疏松多孔,不能保护内层金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述正确的是
的变化如图所示,下列叙述正确的是
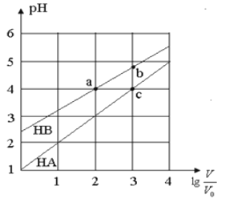
A.该温度下HB的电离平衡常数约等于1.11×10-5
B.相同条件下NaA溶液的pH大于NaB溶液的pH
C.溶液中水的电离程度:a=c>b
D.当![]() =3时,若两溶液同时升高温度,则
=3时,若两溶液同时升高温度,则![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关。 下列叙述错误的是( )
A.还原铁粉能用作食品抗氧化剂
B.“日照遂州江雾开”中伴有丁达尔效应
C.浸泡过KMnO4溶液的硅土可作水果保鲜剂
D.河水中有许多杂质和有害细菌,加入明矾消毒杀菌后可以饮用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学反应原理回答下列问题:
(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.

①该反应的焓变△H__0.(填“>”或“<”)
②该反应在T1温度下5.00min达到平衡,这段时间内N2的化学反应速率为______.
③T1温度下该反应的化学平衡常数K1=______.
(2)科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图所示,则阴极的电极反应式是____________.

(3)已知某些弱电解质在水中的电离平衡常数(25℃)如表:
弱电解质 | H2CO3 | NH3H2O |
电离平衡常数 | Ka1=4.30×10﹣7 Ka2=5.61×10﹣11 | Kb=1.77×10﹣5 |
现有常温下0.1molL﹣1的(NH4)2CO3溶液,
①该溶液呈__性(填“酸”、“中”、“碱”),原因是___________.
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是__.
A.c(NH4+)>c(CO32﹣)>c(HCO3﹣)>c(NH3H2O)
B.c(NH4+)+c(H+)=c(HCO3﹣)+c(OH﹣)+c(CO32﹣)
C.c(CO32﹣)+c(HCO3﹣)+c(H2CO3)=0.1mol/L
D.c(NH4+)+c(NH3H2O)=2c(CO32﹣)+2c(HCO3﹣)+2c(H2CO3)
E.c(H+)+c(HCO3﹣)+c(H2CO3)=c(OH﹣)+c(NH3H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com