
【题目】CH4和H2O(g)在催化剂表面发生反应CH4(g)+H2O(g) ![]() CO(g)+3H2(g),该反应仅在高温下能自发进行。
CO(g)+3H2(g),该反应仅在高温下能自发进行。
(1)该反应的 ΔH ____0(填“<” “>” 或 “=”)。
(2)T ℃时,向2L密闭容器中投入2mol CH4和1.5mol H2O(g),发生上述反应,平衡时CH4的转化率为50%,该温度下反应的平衡常数K=_____。
(3) T ℃时,向1 L密闭容器中投入2 mol CH4、1 mol H2O(g)、3 mol CO、2 mol H2,则反应的v(正)___v(逆) (选填“<” “>”或“=”)
(4)现向三个体积均为2L的恒容密闭容器I、II、Ⅲ中,均分别充入1molCO 和2mo1H2发生反应:CO(g)+2H2(g)![]() CH3OH(g) ΔH1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) ΔH1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。

①5min时三个容器中的反应达到化学平衡状态的是容器_______(填序号)。
②0-5 min内容器I中用CH3OH表示的化学反应速率v(CH3OH)=_______。(保留两位有效数字)
③当三个容器中的反应均达到平衡状态时,CO转化率最高的是容器______。
【答案】> 13.5 > Ⅲ 0.067 mol/(Lmin) Ⅰ
【解析】
(1)根据反应前后气体物质的化学计量数的变化判断该反应的ΔS>0,且已知该反应仅在高温下能自发进行,根据ΔH-TΔS<0反应可自发进行,可知ΔH>0;
(2)根据已知信息列出三段式,计算平衡时刻各物质的浓度,进而计算平衡常数;
(3)计算此刻反应的浓度商,与平衡常数比较,判断反应进行的方向,从而确定正逆反应速率的大小;
(4)①温度越高,反应速率越快,则达到平衡时间越短,其中只有一个容器中的反应已经达到平衡状态,最有可能是Ⅲ,升温平衡逆向移动,氢气含量最大;
②设反应生成的甲醇为x mol/L,根据已知信息可列出三段式,计算生成的甲醇的浓度,进而利用![]() 计算用甲醇表示的化学反应速率;
计算用甲醇表示的化学反应速率;
③该反应为放热反应,温度越低,反应向正方向进行的程度越大,CO转化率越大。
(1)该反应的ΔS>0,已知该反应仅在高温下能自发进行,根据ΔH-TΔS<0反应可自发进行,可知ΔH>0;
故答案为:>;
(2)T ℃时,向2L密闭容器中投入2 mol CH4和1.5mol H2O(g),发生上述反应,平衡时CH4的转化率为50%,根据已知信息可列出三段式:
CH4(g)+H2O(g) ![]() CO(g)+3H2(g)
CO(g)+3H2(g)
开始(mol/L): 1 0.75 0 0
变化(mol/L): 0.5 0.5 0.5 1.5
平衡(mol/L): 0.5 0.25 0.5 1.5
则该温度下反应的平衡常数![]() ;
;
故答案为:13.5;
(3)T ℃时,向1 L密闭容器中投入2 mol CH4、1 mol H2O(g)、3 mol CO、2 mol H2,则此刻反应的浓度商![]() <K,则反应向正反应方向进行,v(正)>v(逆);
<K,则反应向正反应方向进行,v(正)>v(逆);
故答案为:>;
(4)①三个容器的反应温度分别为Tl、T2、T3且恒定不变,当反应均进行到5min时H2的体积分数如图1所示,温度越高反应速率越快,达到平衡时间越短,其中只有一个容器中的反应已经达到平衡状态,最有可能是Ⅲ,升温平衡逆向移动,氢气含量最大;
故答案为:Ⅲ;
②设反应生成的甲醇为x mol/L,则可列出三段式:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
开始(mol/L):0.5 1 0
转化(mol/L):x 2x x
5min时(mol/L):0.5-x 1-2x x
到5min时,氢气的体积分数为0.4,则![]() ,解得x=
,解得x=![]() ,则容器I中用CH3OH
,则容器I中用CH3OH
表示的化学反应速率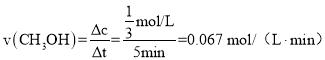 ;
;
故答案为:0.067 mol/(Lmin);
③该反应为放热反应,温度越低,反应向正方向进行的程度越大,则当三个容器中的反应均达到平衡状态时,Ⅰ中CO转化率最大;
故答案为:Ⅰ。


科目:高中化学 来源: 题型:
【题目】(1)在400℃时,将一定量的SO2和14molO2压入一个盛有催化剂的10L密闭容器中进行反应:2SO2+O2![]() 2SO3,已知2min后,容器中剩余2molSO2和12molO2,则:
2SO3,已知2min后,容器中剩余2molSO2和12molO2,则:
①生成了__molSO3,SO2的起始物质的量浓度是__。
②2min内平均反应速率:v(O2)=__。
(2)某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
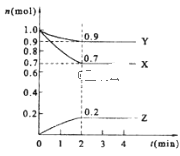
①X的转化率是__;
②由图中所给数据进行分析,该反应的化学方程式为___;
③若三种物质都是气体,则平衡时Y所占体积的百分比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图示的说法正确的是

A. 图甲表示CH4 (g)+2O2 (g)=CO2 (g)+2H2O(1)的能量变化
B. 图乙表示压强对2A(g)+2B(g)![]() 3C(g)+D(g)的影响,且压强:P甲>P乙
3C(g)+D(g)的影响,且压强:P甲>P乙
C. 图丙表示温度对N2 (g)+3H2(g)![]() NH3 (g) △H<0的影响
NH3 (g) △H<0的影响
D. 图丁表示N2 (g)+3H2(g)![]() 2NH3 (g)平衡时NH3体积分数随起始n(N2)/n(H2)的变化,则转化率:αA(H2)=αB(H2)
2NH3 (g)平衡时NH3体积分数随起始n(N2)/n(H2)的变化,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对某难溶电解质AnBm的饱和溶液中,下列说法正确的是
A. 加同温度的水,其溶度积减小、溶解度增大
B. 升高温度,它的溶解度和溶度积都增大
C. 饱和溶液中c(Am+)=c(Bn﹣)
D. 加同温度的水,其溶度积、溶解度均不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种钌(Ru)基配合物光敏染料敏化太阳能电池的原理及电池中发生的主要反应如下图所示,下列说法不正确的是

A. X极为电池的负极 B. 电池工作时,光能转变为电能
C. 电池工作时,Y极上发生还原反应 D. 电池的电解质溶液中I-和I3-的浓度不断减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应热的说法正确的是( )
A.已知甲烷的燃烧热为890.3kJ·mol-1,则表示甲烷燃烧热的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ·mol-1
B.将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6kJ·mol-1
2NH3(g) ΔH=-38.6kJ·mol-1
C.已知C(石墨,s)=C(金刚石,s) ΔH=+1.9kJ·mol-1,说明金刚石具有的能量比石墨低
D.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.4kJ·mol-1,20g氢氧化钠固体溶于稀盐酸中恰好完全反应时放出的热量大于28.7kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是有关外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )
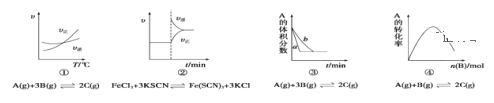
A.①是其他条件一定时,反应速率随温度变化的图像,则逆反应ΔH>0
B.②是在平衡体系的溶液中溶入少量KCl晶体后,化学反应速率随时间变化的图像
C.③是在有无催化剂存在条件下,建立平衡过程的图像,a是使用催化剂时的曲线
D.④是一定条件下,向含有一定量A的恒容密闭容器中逐渐加入B,达平衡时A的转化率的图象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学用如下装置电解食盐水,并对电解产物进行探究。
实验装置 | 电解质溶液 | 实验现象 | |
|
| a极附近 | b极附近 |
开始时,产生白色浑浊并逐渐增加,当沉入U形管底部时部分沉淀变为橙黄色;随后a极附近沉淀自下而上也变为橙黄色 | 产生无色气泡 | ||
资料显示:
①氯化亚铜(CuCl)为白色粉末,微溶于水;
②氢氧化亚铜(CuOH)为黄色不溶于水的固体,易脱水分解为红色的![]() ;
;
③![]() 水溶液中不稳定,酸性条件下易歧化为
水溶液中不稳定,酸性条件下易歧化为![]() 和Cu;
和Cu;
④氢氧化铜可以溶于浓NaOH得到蓝色溶液.
![]() 经检验,b极产生的气体是
经检验,b极产生的气体是![]() ,b极附近溶液的pH______
,b极附近溶液的pH______![]() 填“增大”、“减小”、或“不变”
填“增大”、“减小”、或“不变”![]() ;铜丝a应与电源的______
;铜丝a应与电源的______![]() 填“正”或“负”
填“正”或“负”![]() 极相连。
极相连。
![]() 同学们分析a极附近生成的白色浑浊是CuCl,则该极的电极反应式是______。
同学们分析a极附近生成的白色浑浊是CuCl,则该极的电极反应式是______。
![]() ①橙黄色沉淀中含有
①橙黄色沉淀中含有![]() ,则CuCl转化为
,则CuCl转化为![]() 的原因是______
的原因是______![]() 用方程式表示
用方程式表示![]() ;
;
②结合离子在溶液中的运动规律,解释“
![]() 同学们通过实验进一步证实沉淀中含有
同学们通过实验进一步证实沉淀中含有![]() :将橙黄色沉淀滤出洗涤后,滴加
:将橙黄色沉淀滤出洗涤后,滴加![]()
![]() 至过量,应观察到的现象是______。
至过量,应观察到的现象是______。
![]() 同学们根据上述实验提出猜想:电解时,Cu做阳极先被氧化为
同学们根据上述实验提出猜想:电解时,Cu做阳极先被氧化为![]() 。为此,他们用Cu电极电解
。为此,他们用Cu电极电解![]() NaOH溶液,实验时观察到阳极产生大量无色气泡,附近溶液变蓝,未见预期的黄色沉淀。根据现象能否得出“该猜想不成立”的结论,并说明理由:______。
NaOH溶液,实验时观察到阳极产生大量无色气泡,附近溶液变蓝,未见预期的黄色沉淀。根据现象能否得出“该猜想不成立”的结论,并说明理由:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为V的密闭容器中发生可逆反应![]() ?
?![]() ?
?![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.若A为气态,则气体的平均密度不再变化时反应达到平衡状态
B.升高温度,C的体积分数增大,则该反应正方向放热
C.达到平衡后,向容器中加入B,正反应速率一定增大
D.达到平衡后,若将容器的容积压缩为原来的一半,C的浓度变为原来的![]() 倍,则A一定为非气态
倍,则A一定为非气态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com