
【题目】已知葡萄糖(C6H12O6)的燃烧热是2804kJ·mol-1,当它在人体内氧化生成1g水时放出的热量约为( )
A.26.0kJB.51.9kJC.155.8kJD.467.3kJ
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】以下是一些物质的熔沸点数据(常压):
钾 | 钠 | Na2CO3 | 金刚石 | 石墨 | |
熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
沸点(℃) | 774 | 882.9 | 1850(完全分解产生CO2) | --- | 4250 |
金属钠和CO2在常压、890℃发生如下反应:4Na(g)+3CO2(g) ![]() 2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
(1)上述反应的平衡常数表达式为________________;若4v正(Na)=3v逆(CO2),反应是否达到平衡________ (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min,金属钠的物质的量减少了0.2mol,则10min里CO2的平均反应速率为________________。
(3)高压下有利于金刚石的制备,理由_____________________________________________。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H= —357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(1)的热化学方程式:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚甲基蓝(Methylnene Blue)在碱性条件下与葡萄糖作用生成亚甲基白(Methylene White),亚甲基蓝的结构简式:
著名的蓝瓶子实验操作步骤如下:
①如图示在250mL锥形瓶中,依次加入2g NaOH、100mL H2O和3g葡萄糖,搅拌溶解后,再加入3滴~5滴0.2%的亚甲基蓝溶液,振荡混合液呈现蓝色;
②塞紧橡皮塞(活塞a、b关闭),将溶液静置,溶液变为无色;
③再打开瓶塞,振荡,溶液又变为蓝色;
④再塞紧橡皮塞,将溶液静置,溶液又变为无色,以上③、④可重复多次。
试回答下列问题:

(1)某学生将起初配得的蓝色溶液分装在A,B两支试管中(如上图,A试管充满溶液,B中有少量溶液),塞上橡皮塞静置片刻,两溶液均显无色,若再同时振荡A,B试管,能显蓝色的是_________(填“A”或“B”);
(2)若塞紧锥形瓶塞并打开活塞a、b,通入足量氢气后,再关闭活塞a、b并振荡,溶液能否由无色变为蓝色_________(填“能”或“不能”);若塞紧锥形瓶塞并打开a、b通入足量氧气,溶液能否由无色变为蓝色_________(填“能”或“不能”);
(3)上述转化过程中,葡萄糖的作用是_________,亚甲基蓝的作用是_________;
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为维生素C具有_____;
(5)该实验中③、④操作能否无限次重复进行_________(填“能”或“不能”),理由是 _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:FeCl3(aq)+3KSCN(aq)![]() 3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是
3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是
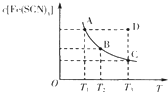
A.A点与B点相比,A点的c(Fe3+)大
B.加入KCl固体可以使溶液由D点变到C点
C.反应处于D点时,一定有υ(正)<υ(逆)
D.若T1、T2温度下的平衡常数分别为K1、K2,则K1<K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蒽(![]() )与苯炔(
)与苯炔(![]() )反应生成化合物X(立体对称图形),如下图所示:
)反应生成化合物X(立体对称图形),如下图所示:

(1)蒽与X都属于________。
a.环烃 b.烃 c.不饱和烃
(2)苯炔的分子式为________,苯炔不具有的性质是________。
a.能溶于水 b.能发生氧化反应
c.能发生加成反应 d.常温常压下为气体
(3)下列属于苯的同系物的是________(填字母)。
A. 
B. 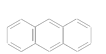
C. 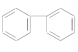
D. ![]()
(4)下列物质中,能发生加成反应,也能发生取代反应,同时能使溴水因加成反应而退色,还能使酸性高锰酸钾溶液退色的是___。
A. ![]()
B.C6H14
C. ![]()
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组以乙烯等为主要原料合成药物普鲁卡因:
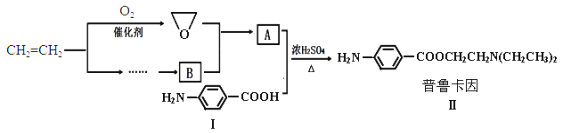
已知:![]() ,
,![]()
(1)对于普鲁卡因,下列说法正确的是___。
a.一个分子中有11个碳原子
b.不与氢气发生加成反应
c.可发生水解反应
(2)化合物Ⅰ的分子式为___,1mol化合物Ⅰ能与___molH2恰好完全反应。
(3)化合物Ⅰ在浓H2SO4和加热的条件下,自身能反应生成高分子聚合物Ⅲ,写出Ⅲ的结构简式___。
(4)请用化学反应方程式表示以乙烯为原料制备B(无机试剂任选)的有关反应,并指出所属的反应类型___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】比较纯碱的两种工业制法,正确的是
选项 | 项目 | 氨碱法 | 联合制碱法 |
A. | 原料 | 食盐、氨气、生石灰 | 食盐、氨气、二氧化碳 |
B. | 可能的副产物 | 氯化钙 | 氯化铵 |
C. | 循环物质 | 氨气、二氧化碳 | 氨气、氯化钠 |
D. | 评价 | 原料易得、产率高 | 设备简单、能耗低 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
a | |||||||||||||||||
b | c | d | e | f | |||||||||||||
g | h | i | j | k | l | m | |||||||||||
n | o | p |
(1)在周期表中,与元素b的化学性质最相似的邻族元素是________(填写以上表中字母对应的元素符号),该元素基态原子核外M层电子的自旋状态________(填“相同”或“相反”)。
(2)元素As与________同族(填写以上表中字母对应的元素符号),其简单气态氢化物的稳定性由大到小的顺序是________。
(3)基态ρ原子成为阳离子时首先失去________轨道电子,基态![]() 的最外层电子排布式________。
的最外层电子排布式________。
(4)i的最高价氧化物对应的水化物与g的最高价氧化物对应的水化物反应的离子方程式为________________。
(5)下列关于上图表中元素说法正确的是________(填序号)。
①未成对电子数最多的元素是O
②元素的电负性强弱;![]()
③元素的第一电离能:![]()
④简单离子半径:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气既是一种优质的能源,又是一种重要化工原料,高纯氢的制备是目前研究的热点。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,甲烷和水蒸气反应的热化学方程式:CH4(g)+2H2O(g)![]() CO2(g)+4H2(g)△H=+165.0kJ·mol-1。
CO2(g)+4H2(g)△H=+165.0kJ·mol-1。
已知反应器中存在如下反应过程式:
Ⅰ.CH4(g)+H2O(g)CO(g)+3H2(g) ΔH1=+206. 4 kJ. mol-1
Ⅱ.CO(g)+H2O(g)CO2(g)+H2(g) H2=___。
(2)某温度下,4molH2O和1 mol CH4在体积为2L的刚性容器内同时发生反应I、Ⅱ,反应达到平衡时,体系中n(CO)=bmol、n(CO2)=dmol,则该温度下反应I的平衡常数K的值为_____用含字母b、d的代数式表示)
(3)欲增大CH4转化为H2的平衡转化率,可采取的措施有_____(填标号)。
A.适当增大反应物的投料比n(H2O):n(CH4)
B.增大压强
C.分离出CO2
(4)H2用于工业合成氨:N2+3H2![]() 2NH3.将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器中反应,反应器的温度变化与从反应器排出的气体中NH3的体积分数φ(NH3)的关系曲线如图,反应器温度高于T0后,NH3的体积分数g(NH3)随温度的升高而减小的原因是____。
2NH3.将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器中反应,反应器的温度变化与从反应器排出的气体中NH3的体积分数φ(NH3)的关系曲线如图,反应器温度高于T0后,NH3的体积分数g(NH3)随温度的升高而减小的原因是____。
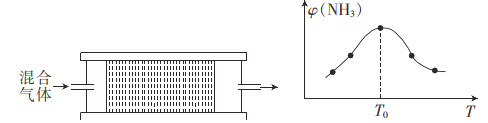
某温度下,n(N2):n(H2)=1:3的混合气体在刚性容器内发生反应,起始时气体总压为p0Pa,平衡时气体总压为0.9p0Pa,则H2的转化率为____,气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学反应平衡常数(记作Kp),则此温度下,该反应的化学平衡常数Kp=_____(用含p0的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com