
【题目】氢气既是一种优质的能源,又是一种重要化工原料,高纯氢的制备是目前研究的热点。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,甲烷和水蒸气反应的热化学方程式:CH4(g)+2H2O(g)![]() CO2(g)+4H2(g)△H=+165.0kJ·mol-1。
CO2(g)+4H2(g)△H=+165.0kJ·mol-1。
已知反应器中存在如下反应过程式:
Ⅰ.CH4(g)+H2O(g)CO(g)+3H2(g) ΔH1=+206. 4 kJ. mol-1
Ⅱ.CO(g)+H2O(g)CO2(g)+H2(g) H2=___。
(2)某温度下,4molH2O和1 mol CH4在体积为2L的刚性容器内同时发生反应I、Ⅱ,反应达到平衡时,体系中n(CO)=bmol、n(CO2)=dmol,则该温度下反应I的平衡常数K的值为_____用含字母b、d的代数式表示)
(3)欲增大CH4转化为H2的平衡转化率,可采取的措施有_____(填标号)。
A.适当增大反应物的投料比n(H2O):n(CH4)
B.增大压强
C.分离出CO2
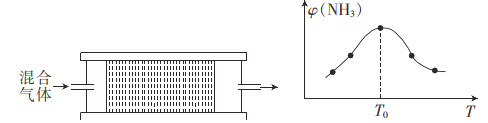
(4)H2用于工业合成氨:N2+3H2![]() 2NH3.将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器中反应,反应器的温度变化与从反应器排出的气体中NH3的体积分数φ(NH3)的关系曲线如图,反应器温度高于T0后,NH3的体积分数g(NH3)随温度的升高而减小的原因是____。
2NH3.将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器中反应,反应器的温度变化与从反应器排出的气体中NH3的体积分数φ(NH3)的关系曲线如图,反应器温度高于T0后,NH3的体积分数g(NH3)随温度的升高而减小的原因是____。
某温度下,n(N2):n(H2)=1:3的混合气体在刚性容器内发生反应,起始时气体总压为p0Pa,平衡时气体总压为0.9p0Pa,则H2的转化率为____,气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学反应平衡常数(记作Kp),则此温度下,该反应的化学平衡常数Kp=_____(用含p0的代数式表示)。
【答案】-41.4 kJ. mol-1 ![]() AC 温度高于T0时反应达到平衡,该反应是正反应放热反应,故温度升高,平衡逆向移动,NH3的体积分数减小 20%
AC 温度高于T0时反应达到平衡,该反应是正反应放热反应,故温度升高,平衡逆向移动,NH3的体积分数减小 20% ![]()
【解析】
(1)利用盖斯定律求出反应Ⅱ的H2;
(2)求出平衡时反应物、生成物的浓度,计算平衡常数;
(3)欲增大CH4转化为H2的平衡转化率,当CH4投料时的物质的量不变,使化学平衡正向移动;
(4)温度低于T0时未达到平衡,温度高于T0时反应达到平衡,该反应是放热反应,根据题意计算出各自的分压,然后计算分压平衡常数。
(1)由盖斯定律可知,H2=△H-ΔH1=165.0kJ·mol-1-206. 4 kJ· mol-1=-41.4 kJ· mol-1;
(2)由n(CO2)=dmol可知反应Ⅱ生成的n(H2)=dmol,同时消耗n(CO)=dmol,同时消耗n(H2O)= dmol,则反应Ⅰ中生成的n(CO)=(b+d)mol,消耗的n(CH4)=(b+d)mol,消耗的n(H2O)=(b+d)mol,生成的n(H2)= (3b+3d)mol,则平衡体系内n(CH4)=(1-b-d) mol、n(H2O)=(4-b-2d)mol、n(CO)=bmol、n(H2)= (3b+4d)mol,,容器的体积为2L,故反应I的平衡常数K=
![]()
![]() =
=![]() ;
;
(3)A.适当增大反应物的投料比n(H2O):n(CH4),增大水的量促进甲烷转化为CO,促进CO转化为CO2,A正确;
B.增大压强,反应Ⅰ的平衡向左移动,B错误;
C.分离出CO2可使平衡向右移动,C正确;
答案选AC。
(4)温度低于T0时未达到平衡,温度升高,反应速率加快,NH3的体积分数增大,温度高于T0时反应达到平衡,该反应是正反应放热反应,故温度升高,平衡常数减小,NH3的体积分数减小;
设初始加入n(N2)=amol,n(H2)=3amol,平衡时H2的转化率为x,则反应中消耗的H2的物质的量为3axmol,反应中消耗的N2的物质的量为axmol,生成NH3的物质的量为2axmol,则达到平衡时,H2的物质的量为(3a -3ax)mol,N2的物质的量为(a -ax)mol,NH3的物质的量为2axmol,在恒温恒容的容器中压强之比等于物质的量之比,故4a:(4a-2ax)= p0:0.9p0,x=20% ,所以平衡时H2的物质的量为2.4amol,N2的物质的量为0.8amol,NH3的物质的量为0.4amol,则它们各自的分压分别为:p (H2)= 0.9p0Pa×[2.4a/(2.4a+0.8a+0.4a)]=0.6 p0Pa,p (N2)= 0.9p0Pa×[0.8a/(2.4a+0.8a+0.4a)]=0.2p0Pa,p (NH3)= 0.9p0Pa×[0.4a/(2.4a+0.8a+0.4a)]
=0.1p0Pa,该反应的化学平衡常数Kp= ![]() 。
。


科目:高中化学 来源: 题型:
【题目】已知葡萄糖(C6H12O6)的燃烧热是2804kJ·mol-1,当它在人体内氧化生成1g水时放出的热量约为( )
A.26.0kJB.51.9kJC.155.8kJD.467.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁带能在CO2中燃烧,生成氧化镁和单质碳。
(1)碳元素形成的单质有金刚石、石墨、足球烯等。金刚石的熔点远高于足球烯的原因是__________________________。24g金刚石中含有____个碳碳单键。
(2)氧化镁的电子式为_______,CO2的结构式为________。与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为________________,其中能量最高的电子有______个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( )

A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、![]() )中回收氧化铁流程如图所示:
)中回收氧化铁流程如图所示:

已知:常温下Ksp[Mg(OH)2]=1.2×10-11;Ksp[Fe(OH)2]=2.2×10-16;Ksp[Fe(OH)3]=3.5×10-38;Ksp[Al(OH)3]=1.0×10-33
(1)写出在该酸性废液中通入空气时发生反应的离子方程式: _________,指出使用空气比使用氯气好的原因是__________。
(2)已知Fe3+(aq)+3OH-(aq)=Fe(OH)3(s) ΔH=-Q1 kJ·mol-1,题(1)中每生成1 mol含铁微粒时,放热Q2,请你计算1 mol Fe2+全部转化为Fe(OH)3(s)的热效应ΔH=________。
(3)常温下,根据已知条件计算在pH=5的溶液中,理论上Fe3+在该溶液中可存在的最大浓度c(Fe3+)=____________。
(4)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时可能混有的杂质是________(填化学式,下同),用________试剂可将其除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的化合物在生产、生活中有广泛应用,其吸收和处理也十分重要。完成下列填空:
(1)SO2具有还原性,可以和许多氧化剂反应。SO2气体通入硫酸酸化的K2Cr2O7溶液中恰好生成铬钾矾[KCr(SO4)2·12H2O]。写出该反应的化学方程式_____________,反应中被还原的元素是__________。
(2)过量的SO2通入Na2S溶液,写出有关的离子方程式____________。
(3)在1L 0.3mol/L的NaOH溶液中,通入4.48LSO2(标况),反应后所得溶液中微粒的浓度之间有一些等量关系,例如:c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),请再写出两个等量关系:_______
(4)在室温下,下列曲线可以描述乙酸(甲、Ki=1.8×10﹣5)和次氯酸(乙、Ki=2.95×10﹣8)在水中的电离度与浓度关系的是_________。
A.
B.
C.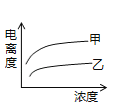
D.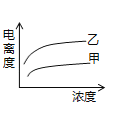
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图.下列说法正确的是( )
![]()
A.x<yB.SO2是该反应的催化剂
C.MFe2Ox是还原剂D.氧化性:MFe2Oy>SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需配制![]()
![]()
![]() 溶液,下列说法不正确的是
溶液,下列说法不正确的是
A.应用托盘天平称取![]() 晶体
晶体![]()
B.配制操作必需的玻璃仪器是烧杯、玻璃棒、胶头滴管、500mL容量瓶
C.采用加热来加快![]() 晶体的溶解,需趁热迅速将溶液转移至容量瓶中
晶体的溶解,需趁热迅速将溶液转移至容量瓶中
D.定容摇匀后发现溶液液面低于刻度线,不需要再滴加蒸馏水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com