
【题目】通过电解法分离NaHSO3与Na2SO3混合物,其装置如下图。下列说法不正确的是

A. 阳极的电极反应式为4OH--4e-==2H2O+O2↑
B. 阳极区c(H+)增大,H+由a室经阳离子交换膜进入b室
C. 外电路每转移0.2 mol电子,有0.2 mol Na+从b室进入c室
D. c室得到Na2SO3的原因是OH-+HSO3- = H2O+SO32-
【答案】C
【解析】
通过电解法分离NaHSO3与Na2SO3混合物,根据装置图分析,电解池阳极发生的反应为物质失去电子,发生氧化反应,考虑到溶液是碱性,则阳极处OH-放电产生O2,阳极电极反应为: 4OH--4e-=2H2O+O2![]() ,阴极为物质得到电子,发生还原反应,考虑到溶液是碱性,则阴极反应式为:2H2O+2e-=2OH-+ H2
,阴极为物质得到电子,发生还原反应,考虑到溶液是碱性,则阴极反应式为:2H2O+2e-=2OH-+ H2![]() ,据此分析判断。
,据此分析判断。
A.阳极的电极反应为: 4OH--4e-=2H2O+O2![]() ,所以A正确;B.阳极区OH-放电被消耗,c(OH-)降低,则c(H+)增加,电解池中阳离子通过阳离子交换膜向阴极移动,则H+由a室经阳离子交换膜进入b室,所以B正确;C.外电路每转移0.2 mol 电子,不仅有Na+转移,还有H+转移,故C错误;D.c室中产生Na2SO3,溶液为碱性,则c室得到Na2SO3的原因是OH-+ HSO3-=H2O+ SO32-,所以D选项是正确的;答案:C。
,所以A正确;B.阳极区OH-放电被消耗,c(OH-)降低,则c(H+)增加,电解池中阳离子通过阳离子交换膜向阴极移动,则H+由a室经阳离子交换膜进入b室,所以B正确;C.外电路每转移0.2 mol 电子,不仅有Na+转移,还有H+转移,故C错误;D.c室中产生Na2SO3,溶液为碱性,则c室得到Na2SO3的原因是OH-+ HSO3-=H2O+ SO32-,所以D选项是正确的;答案:C。


科目:高中化学 来源: 题型:
【题目】CoCO3可用作选矿剂、催化剂及伪装涂料的颜料。以含钴废渣(主要成CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
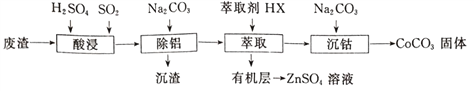
下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
(1)写出“酸溶”时发生氧化还原反应的化学方程式_________________。
(2)“除铝”过程中需要调节溶液pH的范围为______________,形成沉渣时发生反应的离子方程式为_____________________。
(3)在实验室里,萃取操作用到的玻璃仪器主要有____________;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是_________________________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是_________________________。
(4)“沉钴”时,Na2CO3溶液滴加过快会导致产品不纯,请解释原因_________________。
(5)在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672L(标准状况),则该钴氧化物的化学式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物W的分子式为C9H12 ,其含有苯环的结构有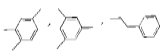 等,下列说法错误的是( )
等,下列说法错误的是( )
A. ![]() 与苯互为同系物
与苯互为同系物
B. 除了上述三种物质,W的含苯环的同分异构体还有5种
C. 有机物W的一种结构为![]() 该有机物不能与溴单质发生加成反应
该有机物不能与溴单质发生加成反应
D. 有机物W不管是否含有苯环,在一定条件下都能发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体内存在着酸碱平衡,如出现失衡将对人体健康产生极大危害。人体内生成的下列酸属于无机物的是
A. 乳酸(C3H6O3) B. 磷酸(H3PO4)
C. 丙酮酸(C3H4O3) D. 乙酰乙酸(C4H6O3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是国民经济发展的重要材料,铝在地壳中的含量约占8%,目前我国铝消费量超过430万吨,在众多的金属中仅次于铁。请回答下问题:
(Ⅰ)实验室中用金属铝制备少量氢氧化铝,有以下3种方案:
方案1:Al![]() Al3+
Al3+![]() Al(OH)3↓
Al(OH)3↓
方案2:Al![]() AlO
AlO![]()
![]() Al(OH)3↓
Al(OH)3↓
方案3: ―→Al(OH)3
―→Al(OH)3
制备相同物质的量的氢氧化铝消耗酸和碱最少的是方案________。
(Ⅱ)工业上冶炼铝的流程图如图所示:

在制取氧化铝的过程中,分析铝土矿和赤泥中所含Al2O3、Fe2O3质量分数的数据如下:

(1)书写化学方程式,反应①________,反应②________。
(2)电解氧化铝生产铝时,阳极的电极反应式为_______________________________________。
(3)假设其他杂质不参加反应,则每生产3.4 t纯净的氧化铝,需铝土矿________t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的碘元素(以I形式存在)。实验室中提取碘的流程如下:

(1)实验操作③的名称是________,所用主要仪器名称为________。
(2)提取碘的过程中,可供选择的有机试剂是________(填序号)。
A.酒精(沸点78 ℃) B.四氯化碳(沸点77 ℃)
C.甘油(沸点290 ℃) D.苯(沸点80 ℃)
(3)在操作②中,溶液中生成少量ICl(ICl的性质类似于氯气),为消除此杂质,使碘全部游离出来,应加入适量________(填序号)溶液,反应的离子方程式___________________。
A.KIO3 B.HClO C.KI D.Br2
(4)利用碘的有机溶液得到单质I2的方法是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将SO2气体通入Ba(NO3)2溶液 | 有白色沉淀 | SO2中混有SO3 |
B | 向NaAlO2溶液中持续通入气体Y | 先出现白色沉淀,最终沉淀又溶解 | Y可能是CO2气体 |
C | AgCl悬浊液中滴入少量Na2S溶液 | 沉淀变黑色 | Ksp(Ag2S)>Ksp(AgCl) |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在平衡: I3- |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com