
【题目】海藻中含有丰富的碘元素(以I形式存在)。实验室中提取碘的流程如下:

(1)实验操作③的名称是________,所用主要仪器名称为________。
(2)提取碘的过程中,可供选择的有机试剂是________(填序号)。
A.酒精(沸点78 ℃) B.四氯化碳(沸点77 ℃)
C.甘油(沸点290 ℃) D.苯(沸点80 ℃)
(3)在操作②中,溶液中生成少量ICl(ICl的性质类似于氯气),为消除此杂质,使碘全部游离出来,应加入适量________(填序号)溶液,反应的离子方程式___________________。
A.KIO3 B.HClO C.KI D.Br2
(4)利用碘的有机溶液得到单质I2的方法是_________________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
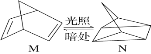
(1)有机物M经过太阳光光照可转化成N,转化过程如下:ΔH=+88.6 kJ·mol-1, 则M与N较稳定的是_________。
(2)已知CH3OH(l)的燃烧热为726.5 kJ·mol-1,CH3OH(l) +1/2 O2(g)===CO2(g)+2H2O(g) ΔH=-a kJ·mol-1,则a________726.5(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时放出145 kJ热量,写出该反应的热化学方程式:_____________________________________________。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为 __________ 。
(5)已知拆开1 mol H-H键、1 mol N-H键、1 mol N≡N 键分别需要的能量是a kJ、b kJ、c kJ,则N2与H2反应生成NH3的热化学方程式为 _________________________________ 。
(6)通过以下反应可获得新型能源二甲醚(CH3OCH3)。
①C(s)+H2O(g)===CO(g)+H2(g) ΔH1=a kJ·mol-1
②CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2=b kJ·mol-1
③CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH3=c kJ·mol-1
④2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH4=d kJ·mol-1
则反应2CO(g)+4H2(g)===CH3OCH3(g)+H2O(g)的ΔH=__________________________________ 。(用含a,b,c,d的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胰蛋白酶作用于一定量的某种物质(底物),温度保持37 ℃,pH保持在最适值,生成物量与反应时间关系如下图。请回答下列问题。
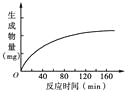
(1)该酶作用的底物是 。
(2)在140 min后,曲线变成水平,这是因为
________________________________________________________________________。
(3)若增加胰蛋白酶浓度,其他条件不变,请在原图上画出生成物量变化的示意曲线。
(4)若胰蛋白酶浓度和其他条件不变,反应液pH由2逐渐升高到10,则酶催化反应的速率将________,原因是____________________________________。
(5)下图中能正确表示胰蛋白酶对底物的分解速率和温度关系的是( )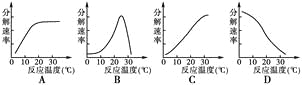
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C均含有10个电子。它们之间转化关系如图所示。下列说法正确的是
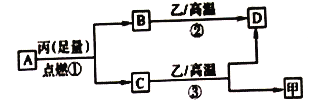
A. 原子半径:Z>Y>X B. 稳定性:A>C
C. 反应②和③均为吸热反应 D. X、Y、Z可以形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过电解法分离NaHSO3与Na2SO3混合物,其装置如下图。下列说法不正确的是

A. 阳极的电极反应式为4OH--4e-==2H2O+O2↑
B. 阳极区c(H+)增大,H+由a室经阳离子交换膜进入b室
C. 外电路每转移0.2 mol电子,有0.2 mol Na+从b室进入c室
D. c室得到Na2SO3的原因是OH-+HSO3- = H2O+SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。在不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。在不同温度时K1、K2的值如下表:
温度(绝对温度) | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
(1)计算温度为973K时,反应CO2(g)+H2(g)![]() CO(g)+H2O(g) K=__________;
CO(g)+H2O(g) K=__________;
(2)目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2进行反应。
CH3OH(g)+H2O(g),在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2进行反应。
①该反应能够自发进行的原因是________。
②下列措施中能使c(CH3OH)增大的是________。
A.降低温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来
D.再充入1 mol CO2和3 mol H2
③在温度T1时,当反应达到平衡时,测得n(H2)=2.4 mol;其他条件不变,在温度T2时,当反应达到平衡时,测得n(CO2)=0.82 mol,则T2________T1(填“>”、“<”或“=”)。
(3)某实验将一定量的CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g) +3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。测得CH3OH的物质的量随时间变化如下图所示,回答问题:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。测得CH3OH的物质的量随时间变化如下图所示,回答问题:

①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ________KⅡ(填“>”、“<”或“=”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物 投入量 | 1 mol CO2、3 mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c mol H2O(g) |
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的浓度相等,且起始时维持反应逆向进行,则c的取值范围为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳正离子[例如,CH3+,CH5+,(CH3)3C+等]是有机反应中重要的中间体。欧拉(G.Olah)因在此领域研究中的卓越成就而荣获1994年诺贝尔化学奖。碳正离子CH5+可以通过CH4在“超强酸”中再获得一个H+而得到,而CH5+失去H2可得CH3+。
(1)CH3+ 是反应性很强的正离子,是缺电子的,其电子式是__________________。
(2)CH3+ 中4个原子是共平面的,三个键角相等,键角应是_________(填角度)。
(3)(CH3)2CH+ 在NaOH的水溶液中反应将得到电中性的有机分子,其结构简式是_____________。
(4)(CH3)3C+ 去掉H+ 后将生成电中性的有机分子,其结构简式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们从蛋白质水解产物中分离出一种含有1个氮原子的氨基酸进行分析时,从0.19g该氨基酸得16mL的氮气(在标准状况下),试计算该氨基酸的含氮量和式量,假如19.95g该氨基酸可以和100mL1.5mol/L的Ba(OH)2溶液恰好完全反应,试推出该氨基酸的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物a(![]() )、b(
)、b(![]() )、c(
)、c(![]() )的说法正确的是
)的说法正确的是
A. a、b、c的分子式均为C8H8
B. a、b、c均能与溴水发生反应
C. a、b、c中只有a的所有原子会处于同一平面
D. a、b、c的一氯代物中,b有1种,a、c均有5种(不考虑立体异构)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com