
【题目】已知X、Y、Z是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C均含有10个电子。它们之间转化关系如图所示。下列说法正确的是
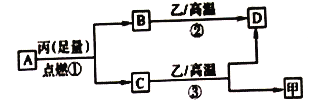
A. 原子半径:Z>Y>X B. 稳定性:A>C
C. 反应②和③均为吸热反应 D. X、Y、Z可以形成离子化合物
【答案】C
【解析】短周期元素中形成的10个电子的化合物主要有CH4、NH3、H2O、HF等几种,根据图中的转化关系可以推出X、Y、Z分别为H、C、O 三种元素,甲、乙、丙分别为氢气、碳、氧气,A、B、C、D分别为CH4、CO2、H2O、CO。
A. H、C、O 三种元素原子半径:C>O>H ,A不正确; B. 氧元素的非金属性强于碳,所以稳定性:H2O>CH4,B不正确;C. 反应②碳和二氧化碳在高温下生成一氧化碳的反应是吸热反应,反应③水蒸气和碳在高温下反应生成氢气和一氧化碳是吸热反应 ,所以C正确; D. H、C、O三种非金属元素只能形成共价化合物,不能形成离子化合物,D不正确。选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用。
sabatior反应:CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
水电解反应:2H2O(l)![]() 2H2(g) + O2(g)
2H2(g) + O2(g)
(1)将原料气按nCO2∶nH2=1:4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
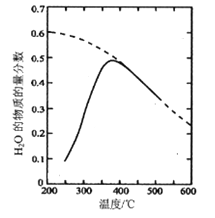
①己知H2(g)、CH4(g)的燃烧热分别为A kJ/mol、BkJ/mol, H2O(l)=H2O(g) △H =C kJ/mol。计算Sabatier反应的△H=___kJ/mol。
②温度过高或过低均不利于该反应的进行,原因是________。
③200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算式为________。(不必化简。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(2)Sabatier反应在空间站运行时,下列措施能提高CO2转化效率的是______(填标号)。
A.适当减压 B.增大催化剂的比表面积
C.反应器前段加热,后段冷却 D.提高原料气中CO2所占比例
E.合理控制反应器中气体的流速
(3) 一种新的循环利用方案是用Bosch反应CO2(g)+2H2(g)![]() C(s)+2H2O(g)代替Sabatier反应。
C(s)+2H2O(g)代替Sabatier反应。
在250℃,向体积为2L且带气压计的恒容密闭容器中通入0.08molH2和0.04molCO2发生Bosch 反应CO2(g)+2H2(g)![]() C(s)+2H2O(g) △ H
C(s)+2H2O(g) △ H
①若反应起始和平衡时温度相同(均为250℃),测得反应过程中压强(P)随时间(t)的变化如图I 曲线a所示,则△H___ 0(填“>”“<”或“不确定”) ;若其它条件相同,仅改变某一条件时,测得其压强(P)随时间(t)的变化如图I 曲线b所示,则改变的条件是______________。
②图II是甲、乙两同学描绘上述反应平衡常数的对数值(lgK)与温度的变化关系,其中正确的曲线是____________(填“甲”或“乙”):m值为____________。

③Bosch反应必须在高温下才能启动,原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列指定溶液中微粒的物质的量浓度关系正确的是
A. 0.1mol·L-1Na2S溶液中:c(OH-)= c(H2S) + c(HS-)
B. 0.1mol·L-1 CH3COONH4溶液中:c(NH4+)+ c(NH3·H2O)=c(CH3COO-) +c(CH3COOH)
C. 0.1mol·L-1pH=6的NaHSO3溶液中:c(Na+) >c(HSO![]() ) >c(SO
) >c(SO![]() )>c(H2SO3)
)>c(H2SO3)
D. 0.1mol·L-1Na2CO3溶液与0.1mol·L-1NaHCO3溶液等体积混合所得溶液中:c(CO![]() ) >c(HCO3-) >c(OH-) >c(H2CO3)
) >c(HCO3-) >c(OH-) >c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)写出图中标序号的对应仪器名称:②_________________,③_______________。仪器②中水流方向为___________(填“上进下出”或 “下进上出”)
(2)选择合适的实验方法分离下列混合物,用代表整套装置的字母填空;
①从氯化钾溶液中得到氯化钾固体,选择装置____________;
②分离饱和食盐水与沙子的混合物,选择装置____________;
③除去自来水中的Cl-等杂质以制取蒸馏水,选择装置____________;
④分离乙醇和水的混合物,选择装置________;
⑤分离汽油和水的混合物,选择装置____________;
(3)分离碘和水的混合物,可选择下列哪种试剂?_______(填序号),所用分离方法为________。
A.四氯化碳 B.乙醇 C.蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,N2O5在CCl4中发生反应:2N2O5===4NO2+O2,N2O5的浓度随反应时间(t)的变化如下表。在0~10 s内,平均反应速率为( )
t/s | 0 | 5 | 10 | 15 |
N2O5/(mol·L-1) | 0.82 | 0.40 | 0.32 | 0.28 |
A. v(N2O5)=0.032 mol·L-1
B. v(N2O5)=0.050 mol·L-1
C. v(N2O5)=0.050 mol·L-1·s-1
D. v(N2O5)=0.032 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A为某种聚甲基丙烯酸酯的单体,其转化关系如下:

己知:I、G的苯环上一氯代物只有两种:
II.RCH=CH2+HBr![]() RCH2CH2Br
RCH2CH2Br
请按要求回答下列问题:
(1)A的结构简式为______, ②的反应类型_____________。
(2)B中官能团的结构为_____________,H的名称____________。
(3)D可以发生缩聚反应,反应的化学方程式为____________。
(4)写出同时满足下列条件的G的同分异构体有_______种
①能发生银镜反应 ②苯环上的一氯取代物有两种
其中1H-NMR谱峰面积之比为l:2:2:2:l,且遇FeCl3溶液显紫色的化合物的结构简式为______
(5)以B为原料合成含六元环的酯类物质,请设计合成路线(用流程图表示,无机试剂任选)。合成流程图示例如下:
CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH_____________
CH3CH2OH_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列说法中正确的是
①20 g D2O含有的电子数为10NA
②含有1molFe(OH)3的氢氧化铁胶体中含有胶粒数为NA
③1 L0.1mol/L的NH4NO3溶液中氮原子数为0.2NA
④ 在标准状况下22.4 L SO3的物质的量为1mol
⑤25℃时,pH=12的l.0LNaClO溶液中水电离出的OH-的数目为0.01NA
⑥常温下,5.6 L NO和5.6 LO2的混合气体中含有的分子数为0.5NA
⑦l mol Na2O2与水完全反应时转移电子数为2NA
A. ③⑥⑦ B. ①③⑤ C. ①②④ D. ④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于SO2和Cl2的叙述错误的是( )
A. 都是大气污染物 B. 都具有漂白性,能使有色物质永久性褪色
C. 水溶液都呈酸性 D. 在相同条件下密度都比空气大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com