
【题目】某温度下,N2O5在CCl4中发生反应:2N2O5===4NO2+O2,N2O5的浓度随反应时间(t)的变化如下表。在0~10 s内,平均反应速率为( )
t/s | 0 | 5 | 10 | 15 |
N2O5/(mol·L-1) | 0.82 | 0.40 | 0.32 | 0.28 |
A. v(N2O5)=0.032 mol·L-1
B. v(N2O5)=0.050 mol·L-1
C. v(N2O5)=0.050 mol·L-1·s-1
D. v(N2O5)=0.032 mol·L-1·s-1
科目:高中化学 来源: 题型:
【题目】我国每年产生的废旧铅蓄电池约330万吨。从含铅废料(PbSO4、PbO2、PbO等)中回收铅,实现铅的再生,意义重大。一种回收铅的工作流程如下:

(1)铅蓄电池放电时,PbO2作____极。
(2)过程I,已知:PbSO4、PbCO3的溶解度(20℃)见图l;Na2SO4、Na2CO3的溶解度见图2。

①根据图l写出过程I的离子方程式:__________。
②生产过程中的温度应保持在40℃,若温度降低,PbSO4的转化速率下降。根据图2,解释可能原因:
i.温度降低,反应速率降低; ii.____(请你提出一种合理解释)。
③若生产过程中温度低于40℃,所得固体中,含有较多Na2SO4杂质,原因是____。
(3)过程Ⅱ,发生反应2PbO2+H2C2O4=2PbO+H2O2+2CO2↑。实验中检测到有大量O2放出,推测PbO2氧化了H2O2,通过实验证实了这一推测。实验方案是____。
(已知:PbO2为棕黑色固体;PbO为橙黄色固体)
(4)过程Ⅲ,将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液,生成Pb,如图3。
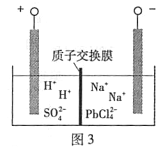
①阴极的电极反应式是____________。
②电解一段时间后,PbCl2'浓度极大下降,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1.5molH2SO4的质量是_____,其中含有___mol 氢原子。
(2)9.03×1023个氨分子含___mol氨分子,___mol氢原子,___个电子。
(3)含有6.02×1023个OH-的Ca(OH)2的物质的量是____,质量是____。
(4)已知16gA和20gB恰好完全反应生成0.04molC和31.76gD,则C的摩尔质量为____。
(5)在同温同压下,相等质量的氧气和臭氧,它们的物质的量之比为____,原子个数比为____。
(6)Fe(OH)3胶体的制备__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸奶中含有乳酸(C3H6O3),2 mol乳酸分子中含有( )
A. 3 mol氧原子
B. 12 mol氢原子
C. 6.02×1023个O3分子
D. 6.02×1023个乳酸分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C均含有10个电子。它们之间转化关系如图所示。下列说法正确的是
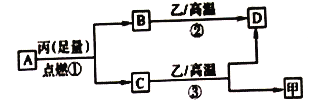
A. 原子半径:Z>Y>X B. 稳定性:A>C
C. 反应②和③均为吸热反应 D. X、Y、Z可以形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”已成为人们熟悉的概念,下列符合“绿色食品”的基本标准的是
①香甜可口 ②无污染 ③表面呈绿色 ④无化学添加剂 ⑤有营养价值
A. ①②③⑤ B. ①③④⑤ C. ①②③④⑤ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠可与CO2作用,当0.2molNa218O2完全作用后,生成的Na2CO3的质量为
A. 21.2g B. 2l.6g C. 22.0g D. 22.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)含有3.01×1023个H的H2O,其H2O物质的量是________;其H2O中含有电子的个数为______________。
(2)______mol H2O中含有的氧原子数与1.5 mol CO2中含有的氧原子数相等。
(3)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为________。
(4)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为__________。
(5)标准状况下,密度为0.75 g·L-1的NH3与CH4组成的混合气体中,NH3的体积分数为__________,(注:体积分数即为物质的量分数)
(6)已知a g A和b g B恰好完全反应生成0.4mol C和d g D,则C的摩尔质量为________
(7)同温、同压下等质量的SO2气体和CO2气体,体积之比___________,原子数目之比为___________,密度比为___________,氧元素的质量比为__________。
(8)某气态氧化物化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为____________;R的相对原子质量为_____________。
(9)200mL、2.0mol/L的Al2(SO4)3溶液中含Al3+的物质的量为___________;从中取出10mL,将这10mL溶液用水稀释到50mL,所得溶液中溶质的物质的量浓度为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com