
����Ŀ����1��1.5molH2SO4��������_____�����к���___mol ��ԭ�ӡ�
��2��9.03��1023�������Ӻ�___mol�����ӣ�___mol��ԭ�ӣ�___�����ӡ�
��3������6.02��1023��OH����Ca(OH)2�����ʵ�����____��������____��
��4����֪16gA��20gBǡ����ȫ��Ӧ����0.04molC��31.76gD����C��Ħ������Ϊ____��
��5����ͬ��ͬѹ�£���������������ͳ��������ǵ����ʵ���֮��Ϊ____��ԭ�Ӹ�����Ϊ____��
��6��Fe(OH)3������Ʊ�__________________________��
���𰸡� 147g 3 1.5 4.5 15NA 0.5mol 37g 106g/mol 3:2 1:1 ���ձ��е�����ˮ���������ڣ����ˮ����μ��뼸��FeCl3������Һ�������������Һ�ʺ��ɫ��ֹͣ����
����������1��1.5molH2SO4�������ǣ�m=nM=1.5mol��98gmol-1=147g���ɻ�ѧʽ��֪��H2SO4��Hԭ�ӵ����ʵ�����������ӵ�2��������Hԭ�����ʵ���Ϊ��1.5mol��2=3mol��
��2��9.03��1023�������ӵ����ʵ���Ϊ��n=N/NA=9.03��1023��6.02��1023mol-1=1.5mol���ɻ�ѧʽ��֪��NH3��Hԭ�ӵ����ʵ����ǰ������ӵ�3��������Hԭ�ӵ����ʵ���Ϊ��1.5mol��3=4.5mol����Ϊ1��Nԭ�Ӻ�7���ӣ�1��H��1���ӣ�����1��NH3���Ӻ�������Ϊ��7+1��3=10������Ϊ1.5molNH3����1.5NA�����ӣ��ʺ�15NA�����ӡ�
��3������6.02��1023��OH-�����ʵ���Ϊ1mol������Ca(OH)2�����ʵ���Ϊ0.5mol������Ϊ��m=nM=0.5mol��74gmol-1=37g��
��4��16gA��20gBǡ����ȫ��Ӧ����0.04molC��31.76gD�����������غ�ɵã�C������Ϊ4.24g����C��Ħ������Ϊ��M=m/n=4.24g��0.04mol=106gmol-1��
��5���������ͳ�����������Ϊmg������ߵ����ʵ���֮��Ϊn(O2)��n(O3)=![]() ��
��![]() =3��2�����ڶ��߶�����Oԭ�ӹ��ɵģ�����������ͬʱOԭ�Ӹ�����ͬ���ʱ�ֵΪ1��1��
=3��2�����ڶ��߶�����Oԭ�ӹ��ɵģ�����������ͬʱOԭ�Ӹ�����ͬ���ʱ�ֵΪ1��1��
��6��Ҫ�Ʊ�Fe(OH)3���壬Ӧ�ڷ�ˮ����εμӱ��͵�FeCl3��Һ�������������Һ�ʺ��ɫ��ֹͣ���ȡ�


 ��Ч���ܿ�ʱ��ҵϵ�д�
��Ч���ܿ�ʱ��ҵϵ�д� �ݾ�ѵ������ϵ�д�
�ݾ�ѵ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ƴ��˵���ҩ�����У���������ǻ�Ϭţ�ǵ��������٣�����ȱ����ζҩ����Ч������½�������Ч����֪����Ľ���Ҫ��������ϸ���Ľǻ������ԣ���������ɵģ�������ǵȵ���Ч�ɷ��������
A. ������Ե����� B. DNA
C. ��Ԫ���� D. ����Ԫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ũ����ȡ������Ϊ50 mL��A��B����NaOH��Һ�У��ֱ�ͨ��һ������CO2����ϡ�͵�100 mL��
(1)��NaOH��Һ��ͨ��һ������CO2����Һ�����ʵ���ɿ����Ǣ�________����________����________����________��

(2)��ϡ�ͺ����Һ����μ���0.1 mol ��L��1�����ᣬ����CO2�����(��״��)����������������ϵ��ͼ��ʾ��
��A���߱�����ԭ��Һͨ��CO2���������������ᷴӦ����CO2����������________mL(��״��)��
��B���߱�����ԭ��Һͨ��CO2��������Һ�����ʵĻ�ѧʽΪ______________________��
��ԭNaOH��Һ�����ʵ���Ũ��Ϊ_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������׳��̷�(FeSO4 7H2O)���ظ����ƾ����׳ƺ췯��(Na2Cr2O7��2H2O)�����Ƕ�����Ҫ�Ļ�����Ʒ����ҵ���Ը�����[��Ҫ�ɷ���[Fe(CrO2)2]Ϊԭ���Ʊ��̷��ͺ췯�ƵĹ���������ͼ��ʾ��
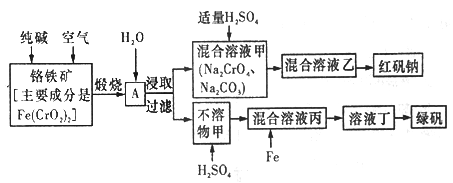
��ش��������⣺
(1)��֪Fe(CrO2)2�и�Ԫ�صĻ��ϼ�Ϊ+3�ۣ���Fe(CrO2)����Ԫ�صĻ��ϼ�Ϊ______________��
(2)��ѧ�Ͽɽ�ijЩ��д�����������ʽ����Na2SiO3д��Na2O��SiO2����Fe(CrO2)2��д��__________��
(3)���ո�����ʱ����ʯ�е�Fe(CrO2)2ת��ɿ�����ˮ��Na2CrO4����Ӧ�Ļ�ѧ����ʽ���£�
4Fe(CrO2)2+8Na2CO3+7O2![]() 2Fe2O3+8Na2CrO4+8CO2
2Fe2O3+8Na2CrO4+8CO2
�ٸ÷�Ӧ�л�ԭ���������������ʵ���֮��Ϊ________________��
��Ϊ�˼ӿ�÷�Ӧ�ķ�Ӧ���ʣ��ɲ�ȡ�Ĵ�ʩ��_________________(��һ�ּ���)��
�ȼ�֪CrO42-��������Ũ�Ȳ�ͬ��������Һ���в�ͬ�ķ�Ӧ���磺
2CrO42-+2H+=Cr2O72-+H2O 3CrO42-+4H+=Cr3O102-+2H2O
���������Һ���м����������������ԭ����________________��
�ڻ����Һ�������ʵĻ�ѧʽΪ______________________��
(5)д��Fe������Һ����Ӧ����Ҫ���ӷ���ʽ_________________��������Һ������Fe3+�ķ����ǣ�_____________������Һ�����̹���ʵ�����Ϊ����Ũ����___________�����ˡ�ϴ�ӡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ������ָ����Һ���������ʵ���Ũ�ȹ�ϵ��ȷ����
A. 0.1mol��L��1Na2S��Һ�У�c(OH��)= c(H2S) + c(HS��)
B. 0.1mol��L��1 CH3COONH4��Һ�У�c(NH4+)+ c(NH3��H2O)=c(CH3COO��) +c(CH3COOH)
C. 0.1mol��L��1pH=6��NaHSO3��Һ�У�c(Na+) ��c(HSO![]() ) ��c(SO
) ��c(SO![]() )��c(H2SO3)
)��c(H2SO3)
D. 0.1mol��L��1Na2CO3��Һ��0.1mol��L��1NaHCO3��Һ��������������Һ�У�c(CO![]() ) ��c(HCO3��) ��c(OH��) ��c(H2CO3)
) ��c(HCO3��) ��c(OH��) ��c(H2CO3)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��W��ԭ����������������ԭ������������֮��Ϊ16��Y��ԭ�Ӱ뾶��X�Ĵ�X��Wͬ���壬Z�ǵؿ��к�����ߵĽ���Ԫ�ء�����˵����ȷ����(����)
A. ԭ�Ӱ뾶�Ĵ�С˳��r(W)��r(Z)��r(Y)
B. Ԫ��X��Yֻ���γ�һ�ֻ�����
C. Ԫ��W�ļ���̬�⻯������ȶ��Ա�X��ǿ
D. Y��W�������������Ӧ��ˮ��������ܽ�Z����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ����ѧ��ѧ�г����ڻ����ķ�����ᴿ��װ�ã������װ�ûش����⣺

��1��д��ͼ�б���ŵĶ�Ӧ�������ƣ���_________________����_______________����������ˮ������Ϊ___________(��Ͻ��³����� ���½��ϳ���)
��2��ѡ����ʵ�ʵ�鷽���������л����ô�������װ�õ���ĸ��գ�
�ٴ��Ȼ�����Һ�еõ��Ȼ��ع��壬ѡ��װ��____________��
�ڷ��뱥��ʳ��ˮ��ɳ�ӵĻ���ѡ��װ��____________��
�۳�ȥ����ˮ�е�Cl-����������ȡ����ˮ��ѡ��װ��____________��
�ܷ����Ҵ���ˮ�Ļ���ѡ��װ��________��
�ݷ������ͺ�ˮ�Ļ���ѡ��װ��____________��
��3��������ˮ�Ļ�����ѡ�����������Լ���_______(�����)�����÷��뷽��Ϊ________��
A�����Ȼ�̼ B���Ҵ� C������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�����N2O5��CCl4�з�����Ӧ��2N2O5===4NO2��O2��N2O5��Ũ���淴Ӧʱ��(t)�ı仯���±�����0��10 s����ƽ����Ӧ����Ϊ(����)
t/s | 0 | 5 | 10 | 15 |
N2O5/(mol��L��1) | 0.82 | 0.40 | 0.32 | 0.28 |
A. v(N2O5)��0.032 mol��L��1
B. v(N2O5)��0.050 mol��L��1
C. v(N2O5)��0.050 mol��L��1��s��1
D. v(N2O5)��0.032 mol��L��1��s��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ���ʵ��֤��ͭ��Ũ�����ܷ�����Ӧ��������������������ʣ���ͼ��ʾ�����Թ������2mLŨ���ᣬ�ô����ܺ�һ��С�Ľ����������ӿ��в���һ��ͭ˿�����ȣ��ѷų�����������ͨ��Ʒ����Һ��ʯ����Һ�С�

��ش��������⣺
��1��д��ͭ��Ũ���ᷴӦ�Ļ�ѧ����ʽ��____________��
��2���Թ�a��b�ֱ����������������ʣ�д���۲쵽�����������á�
�Թ�a�е�����____________________ ��������_____________________________ ��
�Թ�b�е�������__________________ ��������_____________________________ ��
��3��װ���н������ŵ�������___________________________________ ��
��4����ͼ��ͭ˿��Ϊ�ɳ鶯��ͭ˿���ϻ�ѧʵ�顰��ɫ������ԭ����__________________��
��5����ַ�Ӧ��С��ͬѧ����ͭ�����ᶼ��ʣ�ࡣ����ʹʣ���ͭƬ�����ܽ⣬���ټ���____����ѡ�����ĸ����
A��HNO3 B��NaNO3 C��NaHCO3 D��Na2CO3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com