
【题目】硫酸亚铁晶体俗称绿矾(FeSO4 7H2O),重铬酸钠晶体俗称红矾钠(Na2Cr2O7·2H2O),它们都是重要的化工产品。工业上以铬铁矿[主要成分是[Fe(CrO2)2]为原料制备绿矾和红矾钠的工艺流程如图所示。
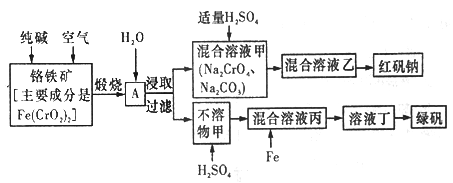
请回答下列问题:
(1)已知Fe(CrO2)2中铬元素的化合价为+3价,则Fe(CrO2)中铁元素的化合价为______________。
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3写成Na2O·SiO2,则Fe(CrO2)2可写成__________。
(3)煅烧铬铁矿时,矿石中的Fe(CrO2)2转变成可溶于水的Na2CrO4,反应的化学方程式如下:
4Fe(CrO2)2+8Na2CO3+7O2![]() 2Fe2O3+8Na2CrO4+8CO2
2Fe2O3+8Na2CrO4+8CO2
①该反应中还原剂与氧化剂的物质的量之比为________________。
②为了加快该反应的反应速率,可采取的措施是_________________(填一种即可)。
⑷己知CrO42-在氢离子浓度不同的酸性溶液中有不同的反应。如:
2CrO42-+2H+=Cr2O72-+H2O 3CrO42-+4H+=Cr3O102-+2H2O
①往混合溶液甲中加入硫酸必须适量的原因是________________。
②混合溶液乙中溶质的化学式为______________________。
(5)写出Fe与混合溶液丙反应的主要离子方程式_________________。检验溶液丁中无Fe3+的方法是:_____________。从溶液丁到绿巩的实验操作为蒸发浓缩、___________、过滤、洗涤、干燥。
【答案】 +2 价 FeO·Cr2O3 4:7 粉碎矿石(或升高温度) H2SO4量少时不能除尽Na2CO3杂质,H2SO4量多时又会生成新的杂质(Cr3O10-2),所以H2SO4必须适量 Na2Cr2O7、Na2SO4 Fe+2Fe3+=3Fe2+ 取少量丁溶液于试管中,向其中加入KSCN溶液,不显红色则说明丁溶液中不含Fe3+ 冷却结晶
【解析】铬铁矿中加入碳酸钠并通入氧气,高温下将Fe(CrO2)2氧化得到Fe2O3、Na2CrO4,同时生成CO2,将得到的固体溶于水得到Na2CrO4溶液,然后过滤,得到得到Na2CrO4和过量的碳酸钠混合溶液和氧化铁固体,在Na2CrO4和碳酸钠混合溶液中加入硫酸酸化,硫酸和Na2CrO4反应生成Na2Cr2O7和硫酸钠,同时除去碳酸钠,通过蒸发浓缩冷却结晶,得到红矾钠(Na2Cr2O7·2H2O);氧化铁与硫酸反应生成硫酸铁,加入铁粉将硫酸铁还原生成硫酸亚铁,最后蒸发浓缩冷却结晶,得到绿矾。
(1) Fe(CrO2)2中铬元素的化合价为+3价,根据正负化合价的代数和为0,Fe(CrO2)中铁元素的化合价为+2价,故答案为:+2 价;
(2) Fe(CrO2)2中铬元素的化合价为+3价,铁元素的化合价为+2价,可写成FeO·Cr2O3,故答案为:FeO·Cr2O3;
(3)①高温氧化时,Fe(CrO2)2和碳酸钠、氧气反应氧化还原反应生成Na2CrO4、二氧化碳和氧化铁,该反应中Fe元素化合价由+2价变为+3价、Cr元素化合价由+3价变为+6价,O元素化合价由0价变为-2价,所以氧气是氧化剂、Fe(CrO2)2是还原剂,则还原剂和氧化剂的物质的量之比为4:7,故答案为:4:7;
②根据影响化学反应速率的外界因素,为了加快该反应的反应速率,可采取的措施有粉碎矿石、升高温度等,故答案为:粉碎矿石(或升高温度);
⑷①H2SO4量少时不能除尽Na2CO3杂质,H2SO4量多时又会生成新的杂质(Cr3O102-),所以H2SO4必须适量,故答案为:H2SO4量少时不能除尽Na2CO3杂质,H2SO4量多时又会生成新的杂质(Cr3O102-),所以H2SO4必须适量;
②根据上述分析,混合溶液乙中的溶质有Na2Cr2O7、Na2SO4,故答案为:Na2Cr2O7、Na2SO4;
(5)Fe与硫酸铁溶液反应的离子方程式为Fe+2Fe3+=3Fe2+。检验溶液丁中无Fe3+的方法为:取少量丁溶液于试管中,向其中加入KSCN溶液,不显红色则说明丁溶液中不含Fe3+;从硫酸亚铁溶液到绿巩的实验操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:取少量丁溶液于试管中,向其中加入KSCN溶液,不显红色则说明丁溶液中不含Fe3+ ;冷却结晶。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】我国每年产生的废旧铅蓄电池约330万吨。从含铅废料(PbSO4、PbO2、PbO等)中回收铅,实现铅的再生,意义重大。一种回收铅的工作流程如下:

(1)铅蓄电池放电时,PbO2作____极。
(2)过程I,已知:PbSO4、PbCO3的溶解度(20℃)见图l;Na2SO4、Na2CO3的溶解度见图2。

①根据图l写出过程I的离子方程式:__________。
②生产过程中的温度应保持在40℃,若温度降低,PbSO4的转化速率下降。根据图2,解释可能原因:
i.温度降低,反应速率降低; ii.____(请你提出一种合理解释)。
③若生产过程中温度低于40℃,所得固体中,含有较多Na2SO4杂质,原因是____。
(3)过程Ⅱ,发生反应2PbO2+H2C2O4=2PbO+H2O2+2CO2↑。实验中检测到有大量O2放出,推测PbO2氧化了H2O2,通过实验证实了这一推测。实验方案是____。
(已知:PbO2为棕黑色固体;PbO为橙黄色固体)
(4)过程Ⅲ,将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液,生成Pb,如图3。
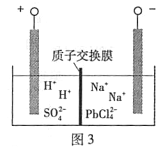
①阴极的电极反应式是____________。
②电解一段时间后,PbCl2'浓度极大下降,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是
A. Na+、Cu2+、Cl-、SO42- B. Ca2+、Na+、NO3-、CO32-
C. H+、Na+、Cl-、CO32- D. K+、H+、S042-、0H-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中关于物质的性质和用途的说法均正确且有因果关系的是
选项 | 性质 | 用途 |
A | 溴化银有感光性 | 用于变色玻璃 |
B | 新制氯水显酸性 | 漂白有色布条 |
C | 浓硫酸有强氧化性 | 干燥剂 |
D | 氨气是碱性气体 | 液氨作制冷剂 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关氧化还原反应的叙述正确的是
A. 一定有一种元素被氧化,另一种元素被还原
B. 在反应中不一定所有元素的化合价都发生变化
C. 非金属单质在反应中只作氧化剂
D. 某元素从化合态变为游离态时,该元素一定被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1.5molH2SO4的质量是_____,其中含有___mol 氢原子。
(2)9.03×1023个氨分子含___mol氨分子,___mol氢原子,___个电子。
(3)含有6.02×1023个OH-的Ca(OH)2的物质的量是____,质量是____。
(4)已知16gA和20gB恰好完全反应生成0.04molC和31.76gD,则C的摩尔质量为____。
(5)在同温同压下,相等质量的氧气和臭氧,它们的物质的量之比为____,原子个数比为____。
(6)Fe(OH)3胶体的制备__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸奶中含有乳酸(C3H6O3),2 mol乳酸分子中含有( )
A. 3 mol氧原子
B. 12 mol氢原子
C. 6.02×1023个O3分子
D. 6.02×1023个乳酸分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠可与CO2作用,当0.2molNa218O2完全作用后,生成的Na2CO3的质量为
A. 21.2g B. 2l.6g C. 22.0g D. 22.4g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com