
【题目】过氧化钠可与CO2作用,当0.2molNa218O2完全作用后,生成的Na2CO3的质量为
A. 21.2g B. 2l.6g C. 22.0g D. 22.4g
 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体俗称绿矾(FeSO4 7H2O),重铬酸钠晶体俗称红矾钠(Na2Cr2O7·2H2O),它们都是重要的化工产品。工业上以铬铁矿[主要成分是[Fe(CrO2)2]为原料制备绿矾和红矾钠的工艺流程如图所示。
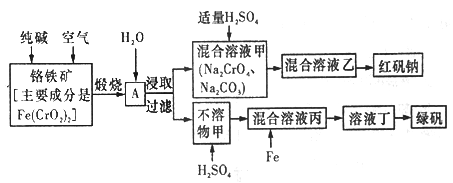
请回答下列问题:
(1)已知Fe(CrO2)2中铬元素的化合价为+3价,则Fe(CrO2)中铁元素的化合价为______________。
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3写成Na2O·SiO2,则Fe(CrO2)2可写成__________。
(3)煅烧铬铁矿时,矿石中的Fe(CrO2)2转变成可溶于水的Na2CrO4,反应的化学方程式如下:
4Fe(CrO2)2+8Na2CO3+7O2![]() 2Fe2O3+8Na2CrO4+8CO2
2Fe2O3+8Na2CrO4+8CO2
①该反应中还原剂与氧化剂的物质的量之比为________________。
②为了加快该反应的反应速率,可采取的措施是_________________(填一种即可)。
⑷己知CrO42-在氢离子浓度不同的酸性溶液中有不同的反应。如:
2CrO42-+2H+=Cr2O72-+H2O 3CrO42-+4H+=Cr3O102-+2H2O
①往混合溶液甲中加入硫酸必须适量的原因是________________。
②混合溶液乙中溶质的化学式为______________________。
(5)写出Fe与混合溶液丙反应的主要离子方程式_________________。检验溶液丁中无Fe3+的方法是:_____________。从溶液丁到绿巩的实验操作为蒸发浓缩、___________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,N2O5在CCl4中发生反应:2N2O5===4NO2+O2,N2O5的浓度随反应时间(t)的变化如下表。在0~10 s内,平均反应速率为( )
t/s | 0 | 5 | 10 | 15 |
N2O5/(mol·L-1) | 0.82 | 0.40 | 0.32 | 0.28 |
A. v(N2O5)=0.032 mol·L-1
B. v(N2O5)=0.050 mol·L-1
C. v(N2O5)=0.050 mol·L-1·s-1
D. v(N2O5)=0.032 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.HD、CuSO4·5H2O都是化合物
B.CO2、NO2和SiO2都是酸性氧化物,都是大气污染物
C.常温下,浓硫酸、浓硝酸与铁均能发生钝化,均能用铁罐储运
D.NaClO和明矾都能作消毒剂或净水剂,加入酚酞试液均显红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列说法中正确的是
①20 g D2O含有的电子数为10NA
②含有1molFe(OH)3的氢氧化铁胶体中含有胶粒数为NA
③1 L0.1mol/L的NH4NO3溶液中氮原子数为0.2NA
④ 在标准状况下22.4 L SO3的物质的量为1mol
⑤25℃时,pH=12的l.0LNaClO溶液中水电离出的OH-的数目为0.01NA
⑥常温下,5.6 L NO和5.6 LO2的混合气体中含有的分子数为0.5NA
⑦l mol Na2O2与水完全反应时转移电子数为2NA
A. ③⑥⑦ B. ①③⑤ C. ①②④ D. ④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中。

请回答下列问题:
(1)写出铜与浓硫酸反应的化学方程式:____________。
(2)试管a、b分别检验生成气体的性质,写出观察到的现象及其作用。
试管a中的现象____________________ ,作用是_____________________________ 。
试管b中的现象是__________________ ,作用是_____________________________ 。
(3)装置中浸碱棉团的作用是___________________________________ 。
(4)如图将铜丝改为可抽动的铜丝符合化学实验“绿色化”的原因是__________________。
(5)充分反应后,小组同学发现铜和硫酸都有剩余。若想使剩余的铜片继续溶解,可再加入____(填选项的字母)。
A.HNO3 B.NaNO3 C.NaHCO3 D.Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种医药中间体,常用于制备抗凝血药。可以通过下图所示的路线合成

已知:RCOOH ![]() RCOCl;D与FeCl3溶液能发生显色。
RCOCl;D与FeCl3溶液能发生显色。
(1)A→B的反应类型是___________,B→C的转化所加的试剂①可能是______。
(2)E的结构简式为_________。
(3)F与足量NaOH溶液充分反应的化学方程式为_________________。
(4)写出同时满足下列条件的所有E的同分异构体的结构简式____________。
①能发生水解反应②与FeCl3溶液能发生显色反应③苯环上有两种不同化学环境的氢原子
(5)己知:酚羟基一般不易直接与羧酸酯化。而苯甲酸苯酚酯(![]() )是一种重要的有机合成中间体。试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)。
)是一种重要的有机合成中间体。试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)。
注:合成路线的书写格式参照如下示例流程图:________________________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把V L含有Na2SO4和Al2(SO4)3的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使Al3+完全转化为![]() ;另一份加入含b mol BaCl2的溶液,恰好使
;另一份加入含b mol BaCl2的溶液,恰好使![]() 完全沉淀为BaSO4。则原混合溶液中Na+的浓度为
完全沉淀为BaSO4。则原混合溶液中Na+的浓度为
A.![]() mol·L-1 B.
mol·L-1 B.![]() mol·L-1
mol·L-1
C.![]() mol·L-1 D.
mol·L-1 D.![]() mol·L-1
mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com