
分析 所给的物质组合中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为NO,能将还原性的FeSO4氧化为Fe2(SO4)3,根据氢原子守恒,水在生成物中,根据化合价升降相等和原子守恒配平后发生的反应,以此解答该题.
解答 解:(1)氧化还原反应的特征为化合价的升降,反应中HNO3为反应物,具有强氧化性,则NO为生成物,反应中硝酸被还原,为氧化剂,题给物质中元素化合价发生变化的还有Fe,则Fe元素化合价应升高,被氧化,则FeSO4应为还原剂,被氧化生成Fe(NO3)3和Fe2(SO4)3,所以Fe(NO3)3和Fe2(SO4)3为氧化产物,
故答案为:FeSO4;Fe(NO3)3和Fe2(SO4)3;
(2)硝酸为氧化剂,在反应中得到电子,由化合价变化可知N元素化合价由+5价降低到+2价,则1mol硝酸反应得到3mol电子,故答案为:得到;3;
(3)当有1mol HNO3被还原,此时生成NO是1mol,在标准状况下NO的体积是22.4L,故答案为:22.4;
(4)根据电子守恒,氮元素的化合价降低了3价,铁元素化合价升高了1价,根据得失电子守恒以及元素守恒,所以硫酸亚铁前边系数是3,硝酸前系数是4,水的前边系数是2,方程式为:4HNO3+3FeSO4=Fe(NO3)3+Fe2(SO4)3+NO↑+2H2O,离子方程式为:4H++NO3-+3Fe2+=3Fe3++NO↑+2H2O;
故答案为:4H++NO3-+3Fe2+=3Fe3++NO↑+2H2O.
点评 本题考查氧化还原反应化学方程式的书写,侧重于从化合价分析氧化产物和还原产物,从原子守恒确定其他反应物或产物,根据根据电子守恒和质量守恒来配平方程式,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 将pH试纸用蒸馏水润湿后,测定稀盐酸的pH值 | |
| B. | 给试管里的液体加热时,试管应与桌面垂直 | |
| C. | 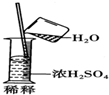 | |
| D. | 浓硫酸不慎沾在皮肤上,应立即用干布拭去,然后用水冲洗,最后再涂上3%~5%的小苏打溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然蛋白质中仅含C、H、O、N四种元素 | |
| B. | 重金属盐能使蛋白质变性,所以误食重金属盐会中毒 | |
| C. | 加热会使蛋白质变性,因此生吃鸡蛋比熟吃好 | |
| D. | 鸡蛋清加入食盐,会使蛋白质变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、SiO2、CO均为酸性氧化物 | |
| B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | |
| C. | 烧碱、氨、四氯化碳均为电解质 | |
| D. | 胶体、食用盐、点豆腐的卤水均为混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 体积:④>①>②>③ | B. | 密度:②>③>④>① | ||
| C. | 质量:②>③>①>④ | D. | 氢原子数:①>②>③>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠的电子式: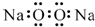 | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | 硫原子的结构示意图: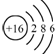 | D. | NH4Cl的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘和四氯化碳形成的溶液可以用蒸馏的方法来分离 | |
| B. | 用萃取的方法分离汽油和煤油 | |
| C. | 用溶解和过滤的方法分离硝酸钾和氯化钠固体混合物 | |
| D. | 将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯制备硝基苯: | |
| B. | 用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 乙醇通入热的氧化铜中:CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O | |
| D. | 实验室用液溴和苯在催化剂作用下制溴苯: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com