
【题目】氯元素是生产生活中常见的非金属元素。
(1)生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
①NaCl和Cl2中化学键的类型分别是________和________。
②燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是__________________
(2)已知:2H2O2(l)===2H2O(l)+O2(g) ΔH1=-196.46 kJ·mol-1
H2(g)+1/2O2(g)===H2O(l) ΔH2=-285.84 kJ·mol-1
Cl2(g)+H2(g)===2HCl(g) ΔH3=-184.60 kJ·mol-1
在催化剂作用下,用H2O2(l)可除去上述燃烧过程中产生的Cl2。依据上述已知反应,写出该反应的热化学方程式:________________________________。
(3)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+NOx→N2+CO2(未配平),若x=1.5,则化学方程式中CO2和N2的化学计量数之比为___。
【答案】离子键 共价键(或非极性键) 2NaCl+SO2+O2![]() Na2SO4+Cl2 H2O2(l)+Cl2(g)===2HCl(g)+O2(g) ΔH=+3.01 kJ/mol 3∶1
Na2SO4+Cl2 H2O2(l)+Cl2(g)===2HCl(g)+O2(g) ΔH=+3.01 kJ/mol 3∶1
【解析】
(1)①NaCl属于离子化合物,含有离子键,Cl2中氯原子之间形成共价键;
②由题目信息可知,SO2与NaCl等物质生成硫酸钠和Cl2,根据S、O原子比例关系可知,应有氧气参与反应,配平书写化学方程式;
(2)发生反应:H2O2(l)+Cl2(g)=2HCl(g)+O2(g),
已知:a:2H2O2(l)===2H2O(l)+O2(g) ΔH1=-196.46 kJ·mol-1
b:H2(g)+1/2O2(g)===H2O(l) ΔH2=-285.84 kJ·mol-1
c:Cl2(g)+H2(g)===2HCl(g) ΔH3=-184.60 kJ·mol-1
根据盖斯定律,a![]() -b+c可得:H2O2(l)+Cl2(g)=2HCl(g)+O2(g),反应热也进行相应的计算,进而书写热化学方程式;
-b+c可得:H2O2(l)+Cl2(g)=2HCl(g)+O2(g),反应热也进行相应的计算,进而书写热化学方程式;
(3)可利用“定一法”进行配平,把CO2的化学计量数定为1,则可以分别配出CO2、NO1.5和N2的系数,然后再化为最简整数,进行计算。
(1)①NaCl是离子化合物,含有的化学键是离子键,Cl2是共价化合物,含有的化学键是非极性共价键;
②每生成1mol Cl2,氯元素转移电子数为2×6.02×1023,已知生成标况下22.4 L Cl2转移电子数为4×6.02×1023,则SO2转移电子数为2×6.02×1023,,生成硫酸盐Na2SO4,其中NaCl和SO2都为还原剂,反应还需要氧气作氧化剂参与,因此反应方程式为2NaCl+SO2+O2![]() Na2SO4+Cl2;
Na2SO4+Cl2;
因此,本题正确答案是:离子键;共价键(或非极性键) ;2NaCl+SO2+O2![]() Na2SO4+Cl2;
Na2SO4+Cl2;
(2)将题干中三个热化学方程式依次编号为a、b、c,a![]() -b+c得H2O2(l)+Cl2(g)===2HCl(g)+O2(g) ,由盖斯定律有ΔH=(-196.46 kJ·mol-1)
-b+c得H2O2(l)+Cl2(g)===2HCl(g)+O2(g) ,由盖斯定律有ΔH=(-196.46 kJ·mol-1)![]() –(-285.84 kJ·mol-1)+( -184.60 kJ·mol-1)=+3.01 kJ/mol ,因此该反应的热化学方程式为H2O2(l)+Cl2(g)===2HCl(g)+O2(g) ΔH=+3.01 kJ/mol。
–(-285.84 kJ·mol-1)+( -184.60 kJ·mol-1)=+3.01 kJ/mol ,因此该反应的热化学方程式为H2O2(l)+Cl2(g)===2HCl(g)+O2(g) ΔH=+3.01 kJ/mol。
因此,本题正确答案是:H2O2(l)+Cl2(g)===2HCl(g)+O2(g) ΔH=+3.01 kJ/mol;
(3)转换过程中发生反应的化学方程式为:CO+NOx→CO2+N2(未配平),若x=1.5,可利用“定一法”进行配平,把CO2的化学计量数定为1,则CO、NO1.5、N2前面的化学计量数分别为:1、![]() 、
、![]() ,然后都乘3,化成整数,即3CO+2NO1.5→3CO2+N2,则化学方程式中CO2与N2的系数之比为3:1,
,然后都乘3,化成整数,即3CO+2NO1.5→3CO2+N2,则化学方程式中CO2与N2的系数之比为3:1,
因此,本题正确答案是::1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是 ( )
A. 等体积、等物质的量浓度的NaHCO3和Ca(OH)2两溶液混合:HCO3-+Ca2++OH-=CaCO3↓+H2O
B. 向澄清石灰水中通入过量的CO2:OH-+CO2=HCO3-
C. 在含3a mol HNO3的稀溶液中,加入a mol 铁粉:4Fe+12H+ +3NO3-=Fe3++3Fe2++3NO↑+6H2O
D. Al2(SO4)溶液中加入过量氨水:Al3++4NH3H2O=AlO2-+4NH4++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家利用下列装置图成功地实现了CO2和H2O合成CH4。下列叙述错误的是

A. 电池工作时,实现了将太阳能转化为电能
B. 铜电极为正极,电极反应式为CO2-8e-+8H+=CH4+2H2O
C. 电池内 H+ 透过质子交换膜从左向右移动
D. 为提高该人工光合系统的工作效率,可向装置中加入少量稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硫的说法不正确的是( )
A.单质硫既有氧化性,又有还原性B.硫在空气中的燃烧产物是二氧化硫
C.铜与硫反应生成黑色的硫化铜D.硫与氢气反应的氧化剂是硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列反应:![]() 设计一个原电池,请选择适当的材料和试剂。
设计一个原电池,请选择适当的材料和试剂。
I.![]() 请写出你选用的正极材料、负极材料、电解质溶液
请写出你选用的正极材料、负极材料、电解质溶液![]() 写化学式
写化学式![]() :正极为_____________ ,电解质溶液:_____________ ;
:正极为_____________ ,电解质溶液:_____________ ;
![]() 负极反应式: ____________________;
负极反应式: ____________________;
![]() 溶液中
溶液中![]() 向 __________ 极移动。
向 __________ 极移动。
II.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
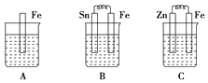
(1)B中Sn极的电极反应式为_________________。
(2)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定体积0.1mol/L醋酸溶液中加入等体积的蒸馏水后,则下列叙述正确的是( )
A.溶液的pH值变小
B.醋酸的电离程度降低
C.溶液的导电能力减弱
D.中和此溶液所需的0.1mol/LNaOH溶液的体积增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的CO2质量进行计算,某同学设计的实验装置示意图如下:

请回答:
(1)仪器a的名称是_____________。
(2)装置B中冰水的作用是_________。
(3)该同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能使碳酸钠的质量分数偏高的是______。
A.样品分解不完全
B.装置B、C之间缺少CO2的干燥装置
C.产生CO2气体的速率太快,没有被碱石灰完全吸收
D.反应完全后停止加热,通入过量的空气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com