
【题目】下列有关阿伏伽德罗常数(NA)的说法错误的是
A. 22.4LO2所含的原子数目为NA B. 0.5molH2O含有的原子数目为1.5NA
C. 1molH2O含有的H2O分子数目为NA D. 0.5molCl2中含有0.5NA 个氯原子
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知氢气和氧气反应生成4.5g水蒸气,同时放出60.45kJ的热量,则下列热化学方程式正确的是( )
A.2H2(g)+O2(g)=2H2O(g)△H=﹣483.6kJ/mol
B.2H2(g)+O2(g)=2H2O(l)△H=﹣483.6kJ/mol
C.2H2(g)+O2(g)=2H2O(g)△H=﹣241.8kJ/mol
D.2H2(g)+O2(g)=2H2O(l)△H=﹣241.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500mL KNO3和Cu(NO3)2的混合溶液中c(NO3﹣)=6.0molL﹣1 , 用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是( )
A.原混合溶液中c(K+)为1 molL﹣1
B.上述电解过程中共转移4 mol电子
C.电解得到的Cu的物质的量为0.5 mol
D.电解后溶液中c(H+)为2 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列实验的描述不正确的是( ) 
A.图(a)所示的实验:根据检流计(G)中指针偏转的方向比较Zn,Cu的金属活泼性
B.图(b)所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀
C.图(c)所示的实验:根据温度计读数的变化用稀盐酸和稀NaOH溶液反应测定中和热
D.图(d)所示的实验:根据两烧瓶中气体颜色的变化判断2NO2(g)N2O4(g)是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ag2SO4的Ksp 为2.0×10-5,将适量Ag2SO4固体溶于水中配成100 mL饱和溶液,该过程中Ag+和SO42-浓度随时间变化关系如图[饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1]。若t1时刻在上述体系中加入100 mL 0.020 mol·L-1 Na2SO4 溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是( )
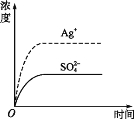
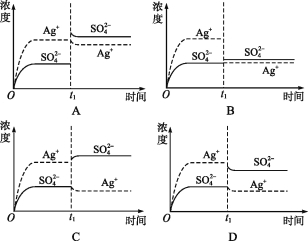
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验HCl气体中是否混有少量Cl2可采用的方法是
A. 凭气味和颜色 B. 通入AgNO3溶液
C. 干燥的蓝色石蕊试纸,观察其颜色变化 D. 紫色石蕊试液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种锂电池,用金属锂和石墨做电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯( ![]() )中而形成的,电池总反应方程式为:8Li+3SOCl2═6LiCl+Li2SO3+2S,下列叙述中正确的是( )
)中而形成的,电池总反应方程式为:8Li+3SOCl2═6LiCl+Li2SO3+2S,下列叙述中正确的是( )
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的正极,石墨作电池的负极
C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42﹣可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( ) 
A.通电后中间隔室的SO42﹣离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O﹣4e﹣=O2+4H+ , 负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物.
(1)铁炭混合物在水溶液中可形成许多微电池.将含有Cr2O72﹣的酸性废水通过铁炭混合物,在微电池正极上Cr2O72﹣转化为Cr3+ , 其电极反应式为 .
(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图1所示. 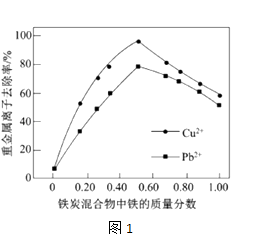
①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+ , 其原因是 .
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是 .
(3)纳米铁粉可用于处理地下水中的污染物. ①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4﹣(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4﹣ , 其离子方程式为 .
②纳米铁粉与水中NO3﹣反应的离子方程式为4Fe+NO3﹣+10H+=4Fe2++NH4++3H2O
研究发现,若pH偏低将会导致NO3﹣的去除率下降,其原因是 .
③相同条件下,纳米铁粉去除不同水样中NO3﹣的速率有较大差异(见图2),产生该差异的可能原因是 . 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com