
【题目】Ⅰ、按要求书写下列化学方程式和名称:
(1)1,3-丁二烯与等物质的量的单质溴在60℃时发生1,4-加成
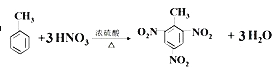
(2)甲苯制备TNT ,用系统命名给TNT命名
(3)乙醛发生银镜反应
Ⅱ、(1)某烃A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,与氢气加成反应可得到结构简式为(CH3)2CHCH(CH3)2的烷烃,则此烯烃可能的结构简式是: (任写一种)。
(2)核磁共振谱表明A分子中只有一种类型的氢。
①用系统命名法给A命名: 。
②A中的碳原子是否都处于同一平面? (填“是”或者“不是”)。
【答案】Ⅰ、(1)CH2=CH-CH=CH2+Br2![]() CH2Br-CH=CH-CH2Br;
CH2Br-CH=CH-CH2Br;
(2) ;
;
2,4,6-三硝基甲苯
(3)CH3CHO+2Ag(NH3)2OH![]() CH3COONH3+H2O+2Ag↓+3NH3
CH3COONH3+H2O+2Ag↓+3NH3
Ⅱ、(1)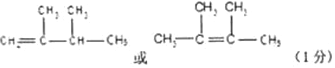
(2)①2,3-二甲基-2-丁稀 ② 是
【解析】
试题分析:
Ⅰ、(1)1,3-丁二烯发生1,4-加成的方程式为:CH2=CH-CH=CH2+Br2![]() CH2Br-CH=CH-CH2Br;
CH2Br-CH=CH-CH2Br;
(2)甲苯制备为: ,TNT称为2,4,6-三硝基甲苯;
,TNT称为2,4,6-三硝基甲苯;
(3)乙醛发生银镜反应为:CH3CHO+2Ag(NH3)2OH![]() CH3COONH3+H2O+2Ag↓+3NH3
CH3COONH3+H2O+2Ag↓+3NH3
Ⅱ、(1)某烯烃经与氢气加成反应可得到结构简式为(CH3)2CHCH(CH3)2的烷烃,在加氢的过程中烃的碳骨架不发生变化,确定相应烯烃的方法为烷烃去氢形成碳碳双键,注意剔除相同结构、单键变双键时碳原子不能超过4个共价键,则此烯烃可能的结构简式是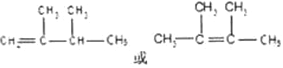
(2)核磁共振谱表明分子中只有一种类型的氢,该烯烃的结构简式为(CH3)2C=C(CH3)2。①用系统命名法给A命名为2,3-二甲基-2-丁烯;②根据乙烯分子的平面形结构分析A中的碳原子都处于同一平面。


科目:高中化学 来源: 题型:
【题目】肉桂酸异戊酯G( )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下:
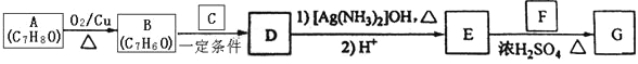
已知以下信息:

②C为甲醛的同系物,相同条件下其蒸气与氢气的密度比为22。
回答下列问题:
(1)A的化学名称为______________。
(2)B和C反应生成D的化学方程式为__________________________________________________________________________。
(3)F中含有官能团的名称为__________________。
(4)E和F反应生成G的化学方程式为__________________________________________________________________________。
(5)F的同分异构体中不能与金属钠反应生成氢气的共有________种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为3:1的为____________________(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂电池应用很广,某种锂离子电池,其正极材料可再生利用。其正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe-=LixC6,现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。
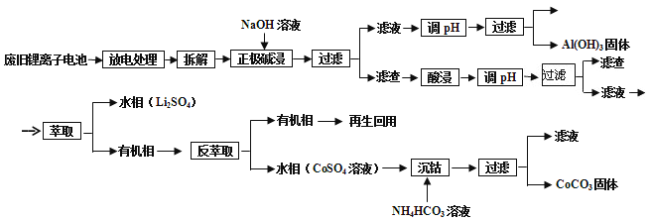
回答下列问题:
(1)写出“正极碱浸”中发生反应的化学方程式____________;
(2)“酸浸”一般在80℃下进行,写出该步骤中发生的主要氧化还原反应的化学方程式________________________;如果可用盐酸代替H2SO4和H2O2的混合溶液,可能发生反应的离子方程式___________________________;
(3)写出“沉钴”过程中发生反应的化学方程式______________________________;
(4)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出充电时正极的电极反应_____________________________________;
(5)在整个回收工艺中,可回收到的金属化合物有____________(填化学式);
(6)最近美国和韩国的科学家合作研究出新型锂—空气电池,他们的锂—空气电池在放电过程中产生稳定的晶状超氧化锂(LiO2),超氧化锂可以很容易地分解成锂和氧,从而具有更高的效率和更长的循环寿命。请写出该电池正极的电极反应 ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇、甲醚是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) △H=-256.1kJmol-1。
CH3CH2OH(g)+H2O(g) △H=-256.1kJmol-1。
已知:H2O(l)=H2O(g)△ H=+44kJmol-1 CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.2kJmol-1
CO2(g)+H2(g) △H=-41.2kJmol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(l) △H=__________________kJmol-1
CH3CH2OH(g)+3H2O(l) △H=__________________kJmol-1
(2)把2molH2和1molCO通入1L的反应器中,一定条件下发生反应:
2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示。
CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示。
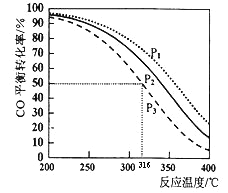
①以下能说明2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g)达平衡状态的是___________
CH3OCH3(g)+H2O(g)达平衡状态的是___________
A.密度不再变化
B.CH3CH2OH蒸汽的体积分数不再变化
C.c(CO)/c(H2)不变
D.[c(CH3OCH3)c(H2O)]/[c(CO)c(H2)]不变
②图中的压强大小为: ,△H___________0(填“>”“<”或“=”),若在P3和316℃时,测得容器中n(H2)=n(CH3OCH3),此时反应的v(正)______v(逆)(填“>”“<”或“=”)。
③P3和316℃时反应的平衡常数________________
(3)汽车使用乙醇汽油并不能更加有效减少NOx的排放,气缸中生成NO的反应为:
N2(g)+O2(g)![]() 2NO(g) △H>0
2NO(g) △H>0
①汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因是_________________
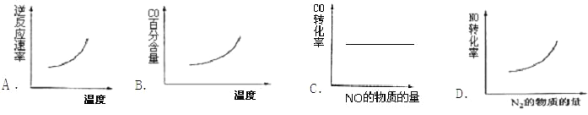
②汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H=-746.8kJ/mol-1。在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是_______
N2(g)+2CO2(g)△H=-746.8kJ/mol-1。在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是_______
(4)乙醇-空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。该电池负极的电极反应式为__________________。用该电池为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O充电,充电一段时间后(假定两极充电前质量相等),测得两极质量差为6.4g时,通过电路电子的物质的量为__________________。
2PbSO4+2H2O充电,充电一段时间后(假定两极充电前质量相等),测得两极质量差为6.4g时,通过电路电子的物质的量为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积不变的密闭容器中,发生反应:2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
(1)当n(NO):n(O2)=4:1时,O2的转化率随时间的变化关系如下图所示。

①A点的逆反应速率v逆(O2)_____B点的正反应速率v正(O2)(填“大于”、“小于”或“等于” )。
②NO的平衡转化率为______;当达到B点后往容器中再以4:1 加入些NO和 O2,当达到新平衡时,则NO的百分含量 B点NO的百分含量(填“大于”、“小于”或“等于” )。
③到达B点后,下列关系正确的是( )
A.容器内气体颜色不再变化 B.v正(NO)=2 v正(O2)
C.气体平均摩尔质量在此条件下达到最大 D.容器内气体密度不再变化
(2)在下图1和图2中出现的所有物质都为气体,分析图1和图2,可推测:4NO(g)+3O2(g)=2N2O5(g) △H= 。
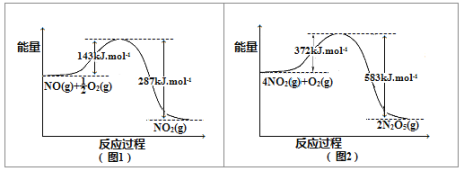

(3)降低温度,NO2(g)将转化为N2O4(g),以N2O4、O2、熔融NaNO3组成的燃料电池装置如右图所示,在使用过程中石墨I电极反应生成一种氧化物Y,Y为 ,有关石墨I电极反应式可表示为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:
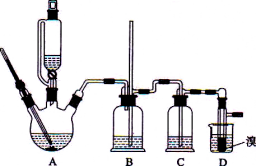
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)烧瓶A中发生的主要的反应方程式_____________________。
(2)装置B的作用是_____________________。
(3)在装置C中应加入___________(填字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)若产物中有少量未反应的Br2,最好用________(填字母)洗涤除去。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇 e.Na2SO3溶液
(5)若产物中有少量副产物乙醚.可用_______________的方法除去。
(6)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是_______________。
(7)判断该制备反应已经结束的最简单方法是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图1中的△H1>△H2
B. 对于可逆反应A(s)+3B(g)![]() 2C(g) △H>0,压强对平衡常数K的影响符合图2
2C(g) △H>0,压强对平衡常数K的影响符合图2
C. 图3表示充满NO2气体的试管,倒置于水槽中,向其中缓慢通入氧气直至试管中全部充满水,假设溶质不扩散,溶质的物质的量浓度与通入氧气的体积关系
D. 由图4可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是石蜡油在炽热碎瓷片的作用下产生C2H4并检验C2H4性质的实验,完成下列各小题。
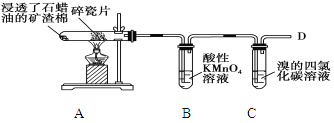
(1)碎瓷片的作用是_____________。
(2)B中现象是________,乙烯发生_______反应。
(3)C中现象是________,发生反应的化学方程式______________________。
(4)在D处点燃时必须进行的操作是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni和Fe在工业生产和新型材料领域有广泛的应用,黄铁矿被称“愚人金”,化学成分是FeS2,晶体属正方体晶系的硫化物矿物。室温为非活性物质。温度升高后变得活泼。在空气中氧化成三氧化二铁和二氧化硫,主要用于接触法制硫酸;回答下列问题:
(1)将FeS2与稀盐酸所对应得到H2S2,H2S2分子中,共价键的类型是___________________;FeS2氧化得到SO2,在SO2分子中的S原子的杂化轨道类型是______________________;
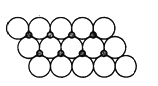
(2)FeS2的晶体中的Fe2+离子的排列方式如下图所示:

①每个Fe2+周围最近的等距离的S22-离子有________个;
②已知FeS2的晶胞参数是a0=54nm,它的密度为_____________gcm-3;(列式并计算,阿伏加德罗常数为6.02×1023)。
(3)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为acm,则该晶体中距离最近的两个阳离子核间的距离为___________(用含有a的代数式表示)。在一定温度下,NiO晶体可以自发地分散并形成“单分子层”(如右图),可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为________g(氧离子的半径为1.40×10-10m,![]() =1.732)。
=1.732)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com