
【题目】实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:
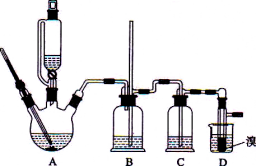
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)烧瓶A中发生的主要的反应方程式_____________________。
(2)装置B的作用是_____________________。
(3)在装置C中应加入___________(填字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)若产物中有少量未反应的Br2,最好用________(填字母)洗涤除去。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇 e.Na2SO3溶液
(5)若产物中有少量副产物乙醚.可用_______________的方法除去。
(6)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是_______________。
(7)判断该制备反应已经结束的最简单方法是_____________________。
【答案】(1)CH3CH2OH![]() CH2 = CH2↑+ H2O(2)平衡压强,作安全瓶,防止倒吸。
CH2 = CH2↑+ H2O(2)平衡压强,作安全瓶,防止倒吸。
(3)c(4)e (5)蒸馏(6)产品熔点低,过度冷却会凝固而堵塞导管。(7)D中溴水完全褪色
【解析】
试题分析:A装置是实验室制取乙烯,B是安全瓶,C是排除干扰装置,D是制取1,2-二溴乙烷装置。
(1)根据上述分析,烧瓶A中发生的主要的反应方程式是CH3CH2OH![]() CH2 = CH2↑+ H2O。
CH2 = CH2↑+ H2O。
(2)根据上述分析,装置B是安全瓶,所以装置B的作用是平衡压强,作安全瓶,防止倒吸。
(3)C是排除干扰装置,浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应,因此,C中加入的是氢氧化钠溶液,其作用是除去可能产生的酸性气体SO2、CO2,答案选c。
(4)因1,2-二溴乙烷在碱性条件下能发生取代反应,所以除去少量的Br2不用NaOH溶液,而是用与Br2反应的Na2SO3溶液,答案选e。
(5)乙醚与其它有机物溶且沸点相关比较大,采用分馏的方法分离。
(6)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,过度冷却会凝固而堵塞导管口,所以不能过度冷却。
(7)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,所以判断反应结束的方法是观察D中溴水完全褪色。


科目:高中化学 来源: 题型:
【题目】某有机物B是一种相对分子质量不超过120的芳香烃含氧衍生物,期中含氧的质量分数为14.8%,B与NaOH溶液不发生反应。有机物A在一定条件下可发生反应
A+H2O B+C。有关C的转化关系如下图所示:
B+C。有关C的转化关系如下图所示:

已知:![]()
根据以上信息,回答下列问题:
(1)B的结构简式为 ,条件I、II中均需要的试剂为 。
(2)有关C的转化关系图中所发生的反应中属于取代反应的有 个。
(3)C的同分异构体中,同时符合下列要求的物质有 种。
a.苯环上有两个侧链 b.能发生银镜反应 c.能发生消去反应
(4)写出F→E转化的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机反应中加氧去氢的反应叫氧化反应,去氧加氢的反应叫还原反应,如乙烯与氢气的加成反应也叫还原反应。1-苯乙醇因具有玫瑰香气味而广泛用于各种食用香精中,实验室用苯乙酮制备1-苯乙醇的反应、装置示意图和有关数据如下:

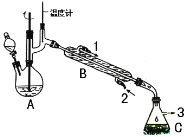
试剂[ | 熔点/℃[ | 沸点/℃ | 密度/g·cm-3 | 溶解性 | ||
水 | 乙醇 | 乙醚 | ||||
1-苯乙醇 | 20 | 203.4 | 1.013 | 不溶 | 溶 | 溶 |
苯乙酮 | 19.7 | 202.3 | 1.028 | 不溶 | 溶 | 溶 |
硼氢化钠 | 36 | 400 | 1.076 | 溶 | 溶 | 不溶 |
乙醇 | -117.3 | 78.4 | 0.789 | 溶 | - | 溶 |
乙醚 | -116.3 | 34.6 | 0.713 | 微溶 | 溶 | - |
实验步骤:
在A中加入15mL 95%的乙醇和1.0g硼氢化钠,搅拌下再滴入8mL苯乙酮,然后在搅拌的条件下,滴加足量的3mol·L-1的盐酸;使A中反应液的温度保持在75-80℃,使其中大部分乙醇蒸发,出现分层,再加入10mL乙醚。将混合反应液倒入分液漏斗中分液,水层再用10mL乙醚萃取,合并两次有机相,再进行简单蒸馏除去乙醚。最后经提纯收集到1-苯乙醇4.5g。
回答下列问题:
(1) 苯乙酮制备1-苯乙醇的反应类型是 ;
(2)仪器B的名称为______________;
(3)反应完成后,加入10mL乙醚,充分振荡后,上层为__________(填“水层”或“有机层”)
(4)反应中加入乙醇的目的是________________________________;
(5)两次合并的有机相进行蒸馏除去乙醚,采用的最佳加热方式是_________(填字母),若回收乙醚,则收集馏分的温度范围是____________________;
a.酒精为加热 b.水浴加热 c.油浴加热 d.酒精喷灯加热
(6)本实验的产率为_____________(保留两位有效数字)。
(7) 1-苯乙醇除用作香料外也用于有机合成,如1-苯乙醇与冰醋酸酯化反应制得乙酸苏合香酯,写出此反应化学反应方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林口服时,具有解热镇痛作用。是一种常用的治疗感冒的药物,也可用于抗风湿,促进痛风患者尿酸的排泄。近年来还发现阿司匹林能抑制血小板凝聚,可防止血栓的生成。它的有效成分是乙酰水杨酸( )。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐【(CH3CO)2O】为主要原料合成乙酰水杨酸。
)。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐【(CH3CO)2O】为主要原料合成乙酰水杨酸。
【反应原理及部分装置】

【实验流程】

已知:①醋酸酐遇水分解生成醋酸。
②水杨酸和乙酰水杨酸均微溶于水,但其钠盐易溶于水,副产物为高分子化合物,难溶于水。
回答下列问题:
(1)合成过程中要控制温度在85℃~90℃,最合适的加热方法 。
(2)用图1装置过滤比普通漏斗过滤的优点是 。
(3)粗产品提纯:
①分批用少量饱和NaHCO3溶液溶解粗产品,目的是 ;判断该过程结束的现象是 。
②加浓盐酸、冷却后的操作是__________、______、干燥、称重、计算产率。
③纯度检验:取少许产品加入盛有2 mL水的试管中,加入1~2滴FeCl3溶液,溶液呈浅紫色。可能的原因是 。
(4)阿司匹林药片中乙酰水杨酸含量的测定步骤(假定只含乙酰水杨酸和辅料,辅料不参与反应):
Ⅰ.称取阿司匹林样品mg;
Ⅱ.将样品研碎,溶于V1 mL a mol/LNaOH(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;
Ⅲ.向锥形瓶中滴加几滴甲基橙,用浓度为b mol/L的标准盐酸滴定剩余的NaOH,消耗盐酸的体积为V2 mL。
已知:乙酰水杨酸与过量NaOH溶液加热发生反应的化学方程式:

则阿司匹林药片中乙酰水杨酸质量分数的表达式为:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、按要求书写下列化学方程式和名称:
(1)1,3-丁二烯与等物质的量的单质溴在60℃时发生1,4-加成
(2)甲苯制备TNT ,用系统命名给TNT命名
(3)乙醛发生银镜反应
Ⅱ、(1)某烃A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,与氢气加成反应可得到结构简式为(CH3)2CHCH(CH3)2的烷烃,则此烯烃可能的结构简式是: (任写一种)。
(2)核磁共振谱表明A分子中只有一种类型的氢。
①用系统命名法给A命名: 。
②A中的碳原子是否都处于同一平面? (填“是”或者“不是”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氮肥厂氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在,该废水的处理流程如下:

(1)过程Ⅰ:加NaOH溶液,其作用用离子方程式表示为____________,调节pH至9后,升温至30℃,通空气将氨赶出并回收;
(2)过程Ⅱ:在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
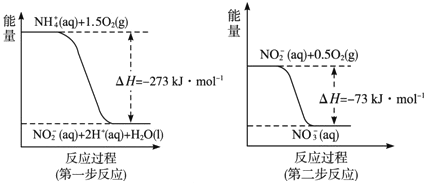
①第一步反应的热化学方程式是____________;
②1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是____________;
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32gCH3OH转移6mol电子,则该反应的化学方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:已知:相关物质的Ksp(20度) AgCl:1.8×10-10 Ag2SO4:1.4×10-5
(1)甲同学的实验如下:

注:经检验黑色固体为Ag。
①白色沉淀的化学式是______________________。
②甲同学得出Ag+氧化了Fe2+的依据是_________________。

(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ。
a.按右图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移。偏移的方向表明:电子由石墨经导线流向银。放置一段时间后,指针偏移减小。
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
①a中甲烧杯里的电极反应式是______________________。
②b中电压表指针逆向偏移后,银为_______________极(填“正”或“负”)。
③由实验得出Ag+和Fe2+反应的离子方程式是___________。
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:

①实验Ⅲ_________(填“能”或“不能”)证明Fe3+氧化了Ag,理由是_______________。
②用化学反应原理解释实验Ⅳ与V的现象有所不同的原因_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B的单质在D的单质中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A的单质在F的单质中燃烧伴有苍白色火焰,产物溶于水得到一种强酸。回答下列问题:
(1)F的元素符号为___________________________。
(2)A在周期表中的位置是 。
(3)A与D反应时,可以形成原电池,在原电池的负极上发生氧化反应的物质是________。
(4)B、D、E组成的一种盐中,E的质量分数为约43%,其俗名为 。
(5)E在D中燃烧产物的电子式为____________________________________。
(6)A与E可以形成离子化合物,该化合物与水反应的方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由N、B等元素组成的新型材料有着广泛用途。
(1)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅制造,由第二周期元素组成的与BCl3互为等电子体的阴离子为_________(填离子符号,填一个)。
(2)氮硼烷化合物(H2N→BH2)和Ti(BH4)3均为广受关注的新型化学氮化物储氢材料。
①H2N→BH2中N原子的杂化类型为_________;
②Ti(BH4)3由TiCl3和LiBH4反应制得。基态Ti3+的未成对电子数有____个,BH4-的立体构型是_________;写出该制备反应的化学方程式_________;
③氮硼烷可由六元环状化合物(HB=NH)3通过如下所对应制得:
3CH4+2(HB=NH)3+6H2O═3CO2+6H3BNH3与上述化学方程式有关的叙述不正确的是_________;.(填标号)
A.氮硼烷中存在配位键
B.第一电离能:N>O>C>B
C.反应前后碳原子的轨道杂化类型不变
D.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形
(3)磷化硼(BP)是受到高度关注的耐麿材料;如图1为磷化硼晶胞。
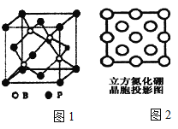
①磷化硼晶体属于________晶体(填晶体类型),________(填是或否)含有配位键。
②晶体中B原子的配位数为_______。
(4)立方氮化硼是一种新型的超硬、耐麿、耐高温的结构材料,其结构和硬度都与金刚石相似,但熔点比金刚石低,原因是________。图2是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和画“×”分别标明B与N的相对位置。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com