
【题目】甲烷作为一种新能源应用广泛,请回答下列问题:
(1)竖炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
CH4(g)+CO2(g) =2CO(g)+2H2(g) △H=260kJ·mol-1
2CO(g)+O2(g) = 2CO2(g) △H= -566kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为____________________
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液)通过装置Ⅱ实现铁棒上镀铜

①a处应通入_________(填CH4或O2),b处电极上发生的电极反应式是______;
②电镀结束后,装置Ⅰ中溶液的pH______。(填写变大、变小或不变,下同),装置Ⅱ中Cu2+的物质的量是________。
【答案】 2CH4(g)+O2(g)=2CO(g)+4H2(g) △H=-46 kJ·mol-1 CH4 O2+2H2O+4e-=4OH- 变小 不变
【解析】试题分析:本题考查盖斯定律的应用,燃料电池和电镀,多池串联装置的分析。
(1)将反应编号:CH4(g)+CO2(g) =2CO(g)+2H2(g)△H=260kJ·mol-1(①式)
2CO(g)+O2(g) = 2CO2(g) △H= -566kJ·mol-1(②式)
应用盖斯定律,将①式![]() 2+②式得,2CH4(g)+O2(g)=2CO(g)+4H2(g)ΔH=(260kJ/mol)
2+②式得,2CH4(g)+O2(g)=2CO(g)+4H2(g)ΔH=(260kJ/mol)![]() 2+(-566kJ/mol)=-46kJ/mol,CH4与O2反应生成CO和H2的热化学方程式为:2CH4(g)+O2(g)=2CO(g)+4H2(g)ΔH=-46kJ/mol。
2+(-566kJ/mol)=-46kJ/mol,CH4与O2反应生成CO和H2的热化学方程式为:2CH4(g)+O2(g)=2CO(g)+4H2(g)ΔH=-46kJ/mol。
(2)装置II实现铁棒上镀铜,Fe电极为阴极,Cu电极为阳极,Fe电极与a处的电极相连,a处电极为燃料电池的负极,b处电极为燃料电池的正极。
①a处电极为燃料电池的负极,a处应通入CH4。b处应通入O2,电解质溶液为KOH溶液,则b处电极上的电极反应式是:O2+4e-+2H2O=4OH-。
②装置I中甲烷燃料电池的电池反应为:CH4+2O2+2KOH=K2CO3+3H2O,KOH被消耗,电镀结束装置I中溶液的pH变小。装置II中Fe电极上的电极反应式为Cu2++2e-=Cu,Cu电极上的电极反应式为Cu-2e-=Cu2+,装置II电镀时Cu2+的物质的量不变。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】I.通常状况下,X、Y和Z是三种气态单质.X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由元素R组成,Y主要分布在平流层大气中,是地球的保护伞。
(1)Y与Z的关系是(选填字母)__________。
a.同位素 b.同系物 c.同素异形体 d.同分异构体
(2)将Y和二氧化硫分别通入品红溶液,都能使品红褪色.简述用褪色的溶液区别二者的实验方法___________。
(3)实验室制备X的化学方程式_____________________________。
II.电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:

(4)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为_____________。在X极附近观察到的现象是_________。
②Y电极上的电极反应式为_________________,检验该电极反应产物的方法是___________。
(5)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是__________,电极反应式为________________________________。
②Y电极的材料是__________,电极反应式为________________________________。(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于合金性质的说法中,错误的是 ( )
A. 多数合金的硬度一般比其各成分金属的硬度高
B. 多数合金的熔点一般比其各成分金属的熔点低
C. 合金的物理性质一般与其各成分金属的物理性质不同
D. 合金的化学性质一般与其各成分金属的化学性质不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸毗醛素是细胞的重要组成部分,其结构式如下,下列有关叙述不正确的是

A. 该物质是一种磷酸酯类化合物
B. 该有机物能发生银镜反应
C. 该有机物可以发生取代、加成、氧化、还原、聚合反应
D. 1mol该有机物与NaOH溶液反应,最多消耗5mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、NO2- 等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2 + CO ![]() CO2 + NO 该反应的平衡常数为K1(下同)
CO2 + NO 该反应的平衡常数为K1(下同)
每1mol下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol K2
2NO(g) ΔH=+179.5 kJ/mol K2
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol K3
2NO2(g) ΔH=-112.3 kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式____________________________以及此热化学方程式的平衡常数K=____________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的![]() ,则反应开始到平衡时CO的平均反应速率v(CO)=________。
,则反应开始到平衡时CO的平均反应速率v(CO)=________。
若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围________________。
(3)电化学降解NO2-的原理如下图:
①电源的负极是____________(填A或B)阴极反应式为________________。
②若电解过程中转移了6mol电子,则膜两侧电解液的质量变化差![]() 为_____g。
为_____g。
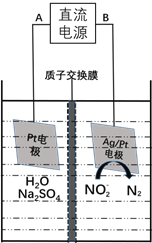
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时有关弱酸的电离平衡常数如下表:
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.4×10-7 K2=4.7×10-11 |
下列推断正确的是
A. 25℃时,同浓度的下列溶液 pH 关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)
B. 若25℃时某溶液中c(CO32-)=c(HCO3-),则此溶液中 c(H+)=4.7×10-11 mol·L-1
C. 若某溶液中c(CO32-)=c(HCO3-),往该溶液中滴入盐酸, HCO3-比CO32-更易结合H+
D. 25℃时pH=9的CH3COONa和NaOH溶液,水电离出的c(H+)均为1×10-9mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质反应后出现黄色的是( )
A. 淀粉遇碘 B. 在新制氢氧化铜中加入葡萄糖溶液
C. 蛋白质与浓硝酸作用 D. 乙醇、乙酸和浓硫酸混合加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com