
【题目】已知碳化钙(化学式为:CaC2)与水反应生成乙炔和Ca(OH)2。请以CaC2为碳源,其它无机试剂任选,写出由CaC2分三步制取[分子式为(C2H3Cl)n]聚氯乙烯的化学方程式:
⑴第一步:___;
⑵第二步:___,反应类型:___;
⑶第三步:___,反应类型:___。
【答案】CaC2+2H2O=Ca(OH)2+C2H2↑ C2H2+HCl→CH2=CHCl 加成反应 nCH2=CHCl![]()
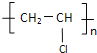 加聚反应
加聚反应
【解析】
由CaC2分三步制取聚氯乙烯,可以先用与水反应生成乙炔,乙炔与氯化氢加成得氯乙烯,氯乙烯再发生加聚反应得聚氯乙烯。
⑴第一步:由CaC2分三步制取聚氯乙烯,可以先用与水反应生成乙炔,反应方程式为CaC2+2H2O = Ca(OH)2+C2H2↑;故答案为:CaC2+2H2O = Ca(OH)2+C2H2↑。
⑵第二步:乙炔与氯化氢加成得氯乙烯,反应方程式为C2H2+HCl→CH2=CHCl,该反应为加成反应;故答案为:C2H2+HCl→CH2=CHCl;加成反应。
⑶第三步:氯乙烯再发生加聚反应得聚氯乙烯,反应方程式为nCH2=CHCl![]()
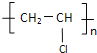 ,该反应为加聚反应,故答案为:nCH2=CHCl
,该反应为加聚反应,故答案为:nCH2=CHCl![]()
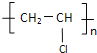 ;加聚反应。
;加聚反应。


科目:高中化学 来源: 题型:
【题目】某种化合物的结构如图所示,其中X、Y、Z、Q、W为原子序数依次增大的五种短周期元素,Q核外最外层电子数与Y核外电子总数相同,X的原子半径是元素周期表中最小的。下列叙述正确的是
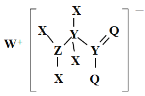
A.Z的最高价氧化物对应的水化物是一元强酸
B.WX的水溶液呈中性
C.元素非金属性的顺序为Y>Z>Q
D.该化合物中与Y单键相连的Q不满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取水煤气反应C(s)+H2O(g)CO(g)+H2(g),化学平衡常数表示为K=![]() ,有关化学平衡常数说法正确的是( )
,有关化学平衡常数说法正确的是( )
A.由表达式可知c(CO)与c(CO)增大时,K值增大
B.其他条件不变时,温度升高,K值增大
C.化学平衡向右移动,K值增大
D.K值变化,化学平衡一定发生了移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器。电解质溶液是KOH溶液,电池总反应为Zn+Ag2O=ZnO+2Ag。请回答下列问题:
(1)该电池的正极材料是________;电池工作时,阳离子向________(填“正极”或“负极”)移动;负极的反应式为__________。
(2)①电极材料锌可由闪锌矿在空气中煅烧成氧化锌,然后用碳还原来制取,化学反应方程式为ZnO+C![]() Zn+CO↑,此法为_____。
Zn+CO↑,此法为_____。
A 电解法 B 热还原法 C 热分解法
(3)可用石墨作电极电解提纯氢氧化钾电解液。电解池内的阳离子交换膜只允许阳离子通过,其工作原理如图所示。
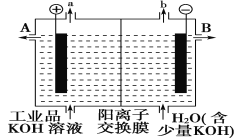
①该电解池的阳极,阴极反应式为阳极:_________阴极:________
②除去杂质后的氢氧化钾溶液从出口________(填“A”或“B”)导出。
③在相同条件下,a处与b处产生的气体体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子的检验方法一定正确的是( )
A.向某溶液中滴加![]() 溶液,有白色沉淀,再滴加足量稀
溶液,有白色沉淀,再滴加足量稀![]() ,若沉淀不溶解,则原溶液中一定含
,若沉淀不溶解,则原溶液中一定含![]()
B.向某溶液中滴加![]() 溶液,若出现红色则原溶液中含
溶液,若出现红色则原溶液中含![]()
C.向某溶液中滴加足量稀盐酸,产生气体使澄清石灰水变浑浊,则原溶液中含![]()
D.用铂丝蘸取某溶液在酒精灯火焰上灼烧,未观察到紫色火焰,则原溶液中不含![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表示下列反应的离子方程式正确的是( )
A.钠与水反应:Na+H2O=Na++OH-+H2↑
B.NaOH溶液与稀硫酸反应:OH-+H+=H2O
C.铁片和稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
D.石灰石与硝酸反应:C![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为![]() 的
的![]() 溶液和
溶液和![]() 溶液按体积分别为Va和Vb混合,保持
溶液按体积分别为Va和Vb混合,保持![]() ,且生成的
,且生成的![]() 可溶于水。已知
可溶于水。已知![]() 与混合液pH关系如图。下列说法错误的是( )
与混合液pH关系如图。下列说法错误的是( )
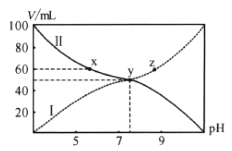
A.曲线Ⅰ表示![]() 溶液体积B.
溶液体积B.![]() 点存在
点存在![]()
C.电离平衡常数![]() D.向
D.向![]() 点溶液加入
点溶液加入![]() ,水的电离程度减小
,水的电离程度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HA的酸性弱于HB的酸性。25℃时,用NaOH固体分别改变物质的量浓度均为0.1molL-1的HA溶液和HB溶液的pH(溶液的体积变化忽略不计),溶液中A-、B-的物质的量浓度的负对数与溶液的pH的变化情况如图所示。下列说法正确的是( )
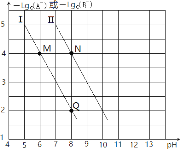
A.曲线Ⅰ表示溶液的pH与-lgc(A-)的变化关系
B.![]() =1000
=1000
C.溶液中水的电离程度:M>N
D.N点对应的溶液中c(Na+)<Q点对应的溶液中c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO是重要化学物质。回答下列问题:
(1)工业生产硝酸时,首先氨氧化反应制备NO,写出该反应的化学方程式:_____________。
(2)工厂排放尾气中NO可用催化剂[La0.8A0.2BCoO3+x(A.B均为过渡元素)]脱除。研究表明,一定温度下,NO的脱除率与还原剂(如H2)、催化剂以及催化剂表面氧缺位(※)的密集程度有关。催化机理如下:
第一阶段:B4+(不稳定)+H2→低价态的金属离子(还原前后催化剂中金属原子的个数不变)
第二阶段:NO(g)+※→NO(吸附态) H1、K1
2NO(吸附态)→2N(吸附态)+O2(g) △H2、K2
2N(吸附态)→N2(g)+2※ △H3、K3
2NO(吸附态)→N2(g) +2O(吸附态) H4、K4
2O(吸附态)→O2(g)+2※ △H5、K5
①第一阶段用H2还原B4+得到低价态的金属离子越多,第二阶段反应的速率越快,其原因是__________________________________。
②根据第二阶段可知,能量大小:NO(g)__________(填“>”“=”或“<”)NO(吸附态)。
③该温度下,NO脱除反应2NO(g)![]() N2(g)+ O2(g)的平衡常数K=_____(用K1、K4、K5的表达式表示)。
N2(g)+ O2(g)的平衡常数K=_____(用K1、K4、K5的表达式表示)。
(3)物质的生成热是指最稳定的单质合成1mol该物质所放出的热量(H);单质的生成热均为0。已知NO(g)、CO(g)、CO2(g)的生成热分别为90.4kJ·mol-1、l10kJ·mol-1、393 kJ·mol-1。则一定条件下,NO(g)与CO(g)反应2NO(g) + 2CO(g)![]() N2(g)+2CO2(g)的△H=_____。
N2(g)+2CO2(g)的△H=_____。
(4)在2 L恒容密闭容器中充入4 mol CO和4 mol NO,发生反应2NO(g) +2CO(g)![]() N2(g)+ 2CO2(g),平衡时,NO的体积分数与温度(℃)、压强(Pa)的关系如图所示。
N2(g)+ 2CO2(g),平衡时,NO的体积分数与温度(℃)、压强(Pa)的关系如图所示。
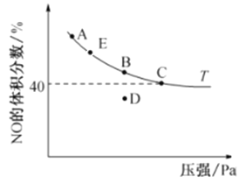
①C点NO的平衡转化率为______;若C点在10 min达到平衡,则10 min内CO的平均反应速率为________。
②若起始容器内压强为力P,则C点时该反应的平衡常数Kp=____ (用平衡分压代替平衡浓度,分压=总压×物质的量分数)。
③若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是________________(从图中A、B、C、E点选填)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com