
【题目】表示下列反应的离子方程式正确的是( )
A.钠与水反应:Na+H2O=Na++OH-+H2↑
B.NaOH溶液与稀硫酸反应:OH-+H+=H2O
C.铁片和稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
D.石灰石与硝酸反应:C![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
科目:高中化学 来源: 题型:
【题目】A 的产量可以用来衡量一个国家的石油化工发展水平,E 是一种具有果香味的有机物(过程中的水或其他物质已省略)。
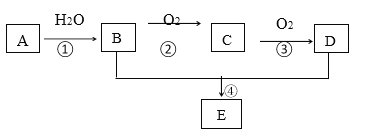
(1)D 分子中的官能团名称是_____。
(2)写出 C 的结构简式:_____
(3)反应①A→B 的反应类型是_____
(4)写出下列反应的化学方程式:B+D→E:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是学习化学的基础,某课外兴趣小组在学了苯与液溴的反应以后,对该反应的类型提出了猜想。
(1)甲组认为苯与液溴的反应是加成反应,乙组则认为苯与液溴的反应是___,对此问题你认为该怎样去证明,说出你的方法:___。
为了证明他们的猜想是否正确,按照如图的实验装置(夹持装置省略)进行实验。

(2)比较装置Ⅰ和装置Ⅱ,选择___(装置Ⅰ或装置Ⅱ),装置Ⅱ的A中CCl4溶液的作用是___。
(3)装有苯和铁粉的仪器名称是___,B集气瓶的作用是___,若试管中出现___现象乙组猜想正确。
(4)写出铁与液溴反应的化学方程式___,苯和液溴反应的化学方程式___。
(5)简要叙述除去溴苯中溴的方法:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钼(![]() )在工业和国防建设中有重要的作用。钼的常见化合价为
)在工业和国防建设中有重要的作用。钼的常见化合价为![]() 。由钼精矿(主要成分是
。由钼精矿(主要成分是![]() )制备单质钼和钼酸钠晶体(
)制备单质钼和钼酸钠晶体(![]() ),部分流程如下图所示:
),部分流程如下图所示:
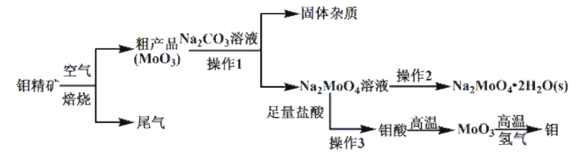
已知:钼酸微溶于水,可溶于碱溶液。
回答下列问题:
(1)钼精矿在空气中焙烧时,发生的主要方程式为_______________________。
(2)钼精矿焙烧时排放的尾气对环境会产生危害,请你提出一种实验室除去该尾气的方法________________________。
(3)操作2的名称为_________________________________。
(4)实验室由钼酸经高温制![]() ,所用到的硅酸盐材料仪器的名称是____________________________。
,所用到的硅酸盐材料仪器的名称是____________________________。
(5)操作1中,加入碳酸钠溶液充分反应后,碱浸液中![]() 、
、![]() ,在结晶前需加入
,在结晶前需加入![]() 固体以除去溶液中的
固体以除去溶液中的![]() 。当
。当![]() 开始沉淀时,
开始沉淀时,![]() 的去除率是_________。[
的去除率是_________。[![]() 、
、![]() ,溶液体积变化可忽略不计]
,溶液体积变化可忽略不计]
(6)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(![]() )。
)。
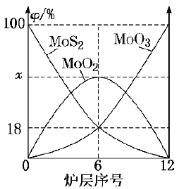
①![]() ___________。
___________。
②焙烧炉中也会发生![]() 与
与![]() 反应生成
反应生成![]() 和
和![]() ,还原剂为_________。若反应中转移
,还原剂为_________。若反应中转移![]() ,则消耗的还原剂的物质的量为______________。
,则消耗的还原剂的物质的量为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知碳化钙(化学式为:CaC2)与水反应生成乙炔和Ca(OH)2。请以CaC2为碳源,其它无机试剂任选,写出由CaC2分三步制取[分子式为(C2H3Cl)n]聚氯乙烯的化学方程式:
⑴第一步:___;
⑵第二步:___,反应类型:___;
⑶第三步:___,反应类型:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石灰石是一种化工原料,可以通过反应生成一系列物质,如图::
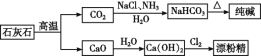
下列说法正确的是( )
A.漂粉精是混合物,主要成分是氯化钙
B.图示的制纯碱方法,要求先向饱和食盐水中通NH3,,然后再通CO2
C.纯碱属于碱,俗名苏打
D.制取纯碱和漂粉精所涉及的反应都是非氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制硫酸的一步重要反应是2SO2(g)+O2(g)![]() 2SO3(g),此反应在某条件下的某密闭反应容器中达到化学平衡状态。下列有关说法不正确的是( )
2SO3(g),此反应在某条件下的某密闭反应容器中达到化学平衡状态。下列有关说法不正确的是( )
A.此时,SO2的转化率达到最大程度
B.此时,SO2的消耗速率等于SO2的生成速率
C.此时,SO3的浓度保持不变
D.该反应达到化学平衡状态后反应停止
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵是一种常见的强氧化剂,常用作火箭发射的推进剂。根据下列信息回答问题:
已知:①高氯酸铵受热分解为N2、Cl2、O2和H2O;②Mg3N2易水解;③Cu与N2在酒精灯加热条件下不反应。
(1)写出高氯酸铵受热分解的化学反应方程式: _____________,Mg3N2的电子式为________。
(2)现有23.5g NH4ClO4分解,用下列装置设计实验,验证其分解产物并计算分解率。(注:①装置中空气已除尽;②装置可重复使用;③B~F装置中的试剂均过量且能与相应物质反应完全。)
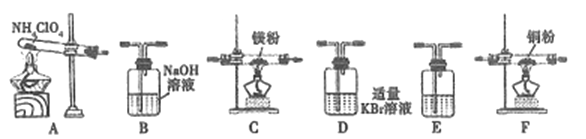
①用E装置质量的增加来验证生成的气体产物之一,则E中盛放的试剂是:_______。
②请按气流由左至右的方向连接装置:A →E→D →B→______→_____→_______→E (选择B~F装置,并用B~F字母填空)。
③证明产物中有Cl2的实验现象:________。
④反应结束后,若C装置质量增加了2.38g,则NH4ClO4的分解率是:________%。
(3)样品中NH4ClO4的含量(杂质中不含NH4+)还可用蒸馏法测定(如图所示,加热和夹持装置已略去),实验步骤如下:

步骤1:组装仪器,检查气密性;准确称取样品a g(不超过0.5g)于蒸馏烧瓶中,加入约150mL水溶解。
步骤2:准确量取40.00mL 约0.1mol/L H2SO4于锥形瓶中。
步骤3:向蒸馏烧瓶中加入20mL 3mol/L NaOH溶液;加热蒸馏使NH3全部挥发。
步骤4:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤5:向锥形瓶中加2~3滴甲基橙,用c mol/L NaOH标准溶液滴定至终点,消耗NaOH标准溶液V1 mL。
步骤6:重复实验2~3次。
回答下列问题:
①步骤2中,准确量取40.00ml H2SO4 溶液的玻璃仪器是: __________。
②为获得样品中NH4ClO4的含量,还需补充的实验是:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚甲基蓝(Methylnene Blue)在碱性条件下与葡萄糖作用生成亚甲基白(Methylene White),亚甲基蓝的结构简式:
著名的蓝瓶子实验操作步骤如下:
①如图示在250mL锥形瓶中,依次加入2g NaOH、100mL H2O和3g葡萄糖,搅拌溶解后,再加入3滴~5滴0.2%的亚甲基蓝溶液,振荡混合液呈现蓝色;
②塞紧橡皮塞(活塞a、b关闭),将溶液静置,溶液变为无色;
③再打开瓶塞,振荡,溶液又变为蓝色;
④再塞紧橡皮塞,将溶液静置,溶液又变为无色,以上③、④可重复多次。
试回答下列问题:

(1)某学生将起初配得的蓝色溶液分装在A,B两支试管中(如上图,A试管充满溶液,B中有少量溶液),塞上橡皮塞静置片刻,两溶液均显无色,若再同时振荡A,B试管,能显蓝色的是_________(填“A”或“B”);
(2)若塞紧锥形瓶塞并打开活塞a、b,通入足量氢气后,再关闭活塞a、b并振荡,溶液能否由无色变为蓝色_________(填“能”或“不能”);若塞紧锥形瓶塞并打开a、b通入足量氧气,溶液能否由无色变为蓝色_________(填“能”或“不能”);
(3)上述转化过程中,葡萄糖的作用是_________,亚甲基蓝的作用是_________;
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为维生素C具有_____;
(5)该实验中③、④操作能否无限次重复进行_________(填“能”或“不能”),理由是 _____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com