
【题目】金属钼(![]() )在工业和国防建设中有重要的作用。钼的常见化合价为
)在工业和国防建设中有重要的作用。钼的常见化合价为![]() 。由钼精矿(主要成分是
。由钼精矿(主要成分是![]() )制备单质钼和钼酸钠晶体(
)制备单质钼和钼酸钠晶体(![]() ),部分流程如下图所示:
),部分流程如下图所示:
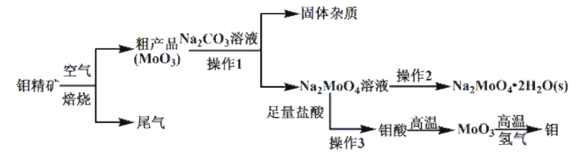
已知:钼酸微溶于水,可溶于碱溶液。
回答下列问题:
(1)钼精矿在空气中焙烧时,发生的主要方程式为_______________________。
(2)钼精矿焙烧时排放的尾气对环境会产生危害,请你提出一种实验室除去该尾气的方法________________________。
(3)操作2的名称为_________________________________。
(4)实验室由钼酸经高温制![]() ,所用到的硅酸盐材料仪器的名称是____________________________。
,所用到的硅酸盐材料仪器的名称是____________________________。
(5)操作1中,加入碳酸钠溶液充分反应后,碱浸液中![]() 、
、![]() ,在结晶前需加入
,在结晶前需加入![]() 固体以除去溶液中的
固体以除去溶液中的![]() 。当
。当![]() 开始沉淀时,
开始沉淀时,![]() 的去除率是_________。[
的去除率是_________。[![]() 、
、![]() ,溶液体积变化可忽略不计]
,溶液体积变化可忽略不计]
(6)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(![]() )。
)。
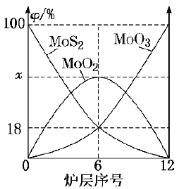
①![]() ___________。
___________。
②焙烧炉中也会发生![]() 与
与![]() 反应生成
反应生成![]() 和
和![]() ,还原剂为_________。若反应中转移
,还原剂为_________。若反应中转移![]() ,则消耗的还原剂的物质的量为______________。
,则消耗的还原剂的物质的量为______________。
【答案】![]() 可用氨水或氢氧化钠溶液吸收等其他合理答案 蒸发浓缩、冷却结晶、过滤、洗涤、干燥 坩埚 95.6% 64
可用氨水或氢氧化钠溶液吸收等其他合理答案 蒸发浓缩、冷却结晶、过滤、洗涤、干燥 坩埚 95.6% 64 ![]()
![]()
【解析】
根据流程图信息分析得:灼烧泪精矿,MoS2燃烧,反应方程式为2MoS2+7O2![]() 2MoO3+4SO2,碱性条件下,MoO3和Na2CO3溶液反应,反应方程式为MoO3+CO32-=MoO42-+CO2↑,溶液中的溶质为Na2MoO4,将溶液蒸发浓缩、冷却结晶,然后重结晶得到Na2MoO4·2H2O,Na2MoO4与足量盐酸反应生成钼酸,高温灼烧钼酸生成MoO3,.氢气还原MoO3得到Mo,以此解答该题。
2MoO3+4SO2,碱性条件下,MoO3和Na2CO3溶液反应,反应方程式为MoO3+CO32-=MoO42-+CO2↑,溶液中的溶质为Na2MoO4,将溶液蒸发浓缩、冷却结晶,然后重结晶得到Na2MoO4·2H2O,Na2MoO4与足量盐酸反应生成钼酸,高温灼烧钼酸生成MoO3,.氢气还原MoO3得到Mo,以此解答该题。
(1)根据流程图分析知,钼精矿焙烧时,反应方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)钮精矿焙烧时排放的尾气含有二氢化硫,会形成酸雨:二氢化硫为酸性氧化物,可用氨水或氢氢化钠溶液吸收,故答案为:可用氨水或氢氧化钠溶液吸收;
(3)操作2是从Na2MoO4溶液中获取Na2MoO4·2H2O晶体,操作是将溶液蒸发浓缩、冷却结晶,然后过滤、洗涤、干燥,故答案为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(4)高温灼烧钼酸生成MoO3,所用的硅酸盐材料仪器为坩埚,故答案为:坩埚;
(5)已知:![]() 、
、![]() ,
,![]() ,
,![]() ,当BaMoO4开始沉淀时,c(Ba2+)=
,当BaMoO4开始沉淀时,c(Ba2+)=![]() ,此时c(SO42-)=
,此时c(SO42-)=![]() ,则SO42-的去除率=
,则SO42-的去除率=![]() ,故答案为:95.6%;
,故答案为:95.6%;
(6)①由图2可知,6层中存在的固体物质分别为MoS2、MoO3、MoO2,图象分析MoS2、MoO3的物质的量百分比均为18%,根据Mo元素守恒,则MoO2的物质的量百分比为64%,则x为64;故答案为:64;
②MoS2与MoO3反应生成MoO2和SO2,反应为:![]() ,其中MoS2中Mo元素化合价不变,S元素由-2升高到+4价,被氧化,作还原剂;则转移12mol电子时,消耗的还原剂的物质的量为1mol,反应中转移
,其中MoS2中Mo元素化合价不变,S元素由-2升高到+4价,被氧化,作还原剂;则转移12mol电子时,消耗的还原剂的物质的量为1mol,反应中转移![]() ,消耗的还原剂的物质的量为0.25mol,故答案为:
,消耗的还原剂的物质的量为0.25mol,故答案为:![]() ;
;![]() 。
。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽。用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中正确的是( )
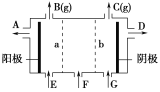
A.b是阳离子交换膜,允许Na+通过
B.从A口出来的是NaOH溶液
C.阴极反应式为4OH--4e-=2H2O+O2↑
D.Na2SO4溶液从F口加入
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料的过程。水煤气生产原理为:C(s)+H2O(g)![]() CO(g)+H2(g)-131.3kJ。
CO(g)+H2(g)-131.3kJ。
(1)该反应的平衡常数K的表达式__;温度升高,K值__(填“变大”、“不变”或“变小”)。
(2)一定温度下,在一个容积不变的密闭容器中进行水煤气的生产反应,下列能判断该反应达到化学平衡状态的是__。
A.容器内压强不变 B.容器内气体密度不变
C.v(CO)=v(H2O) D.c(CO)=c(H2)
(3)如反应的容器容积为1.0L,反应时间为5.0min,容器内气体密度增大了0.12g/L,在这段时间内CO的平均反应速率为__。
(4)研究表明:在使用等质量催化剂时,增大催化剂的表面积可提高化学反应速率,为了分别验证温度,催化剂的表面积对化学反应速率的影响规律,至少应该设计__个实验。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都为短周期元素,A的核外电子数和周期数相等;B的+1价阳离子和C的―1价阴离子都与氖原子具有相同的电子层结构;D在C的下一周期,可与B形成BD型离子化合物;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸。请根据以上信息回答下列问题。
(1)B元素在元素周期表中的位置是第___周期___族。
(2)画出D元素的原子结构示意图___,E元素形成的分子的电子式___。
(3)与E的氢化物分子所含电子总数相等的分子是___(举一例、填化学式,下同),离子是___。
(4)A与C形成的化合物中含有化学键的类型是___。
(5)D的单质与B的最高价氧化物对应的水化物的溶液发生反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器。电解质溶液是KOH溶液,电池总反应为Zn+Ag2O=ZnO+2Ag。请回答下列问题:
(1)该电池的正极材料是________;电池工作时,阳离子向________(填“正极”或“负极”)移动;负极的反应式为__________。
(2)①电极材料锌可由闪锌矿在空气中煅烧成氧化锌,然后用碳还原来制取,化学反应方程式为ZnO+C![]() Zn+CO↑,此法为_____。
Zn+CO↑,此法为_____。
A 电解法 B 热还原法 C 热分解法
(3)可用石墨作电极电解提纯氢氧化钾电解液。电解池内的阳离子交换膜只允许阳离子通过,其工作原理如图所示。
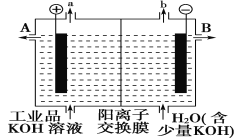
①该电解池的阳极,阴极反应式为阳极:_________阴极:________
②除去杂质后的氢氧化钾溶液从出口________(填“A”或“B”)导出。
③在相同条件下,a处与b处产生的气体体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物X、Y、Z的分子式都是C7H8O,当它们处于液体状态时,分别滴入到FeCl3溶液,只有Z呈紫色,若投入金属钠,只有Y无现象,下列说法不正确的是( )
A.Z的官能团名称为羟基
B.X属于醇类
C.Y没有同类物质的同分异构体
D.Z的结构简式只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表示下列反应的离子方程式正确的是( )
A.钠与水反应:Na+H2O=Na++OH-+H2↑
B.NaOH溶液与稀硫酸反应:OH-+H+=H2O
C.铁片和稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
D.石灰石与硝酸反应:C![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
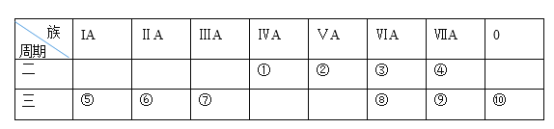
(1)非金属性最强的元素是______(填元素符号,下同),形成化合物种类最多的元素是________________________。
(2)第三周期元素除⑩外原子半径最小的是______(填元素符号),
(3)这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________。
(4)⑤、⑧两种元素的最高价氧化物对应的水化物相互反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一杯咖啡中含有0.194g咖啡因(分子式C8H10N4O2,M=194g/mol),你知道其中有_______个咖啡因分子;这些咖啡因分子中的N原子的物质的量为_________.
(2)经检测一瓶泉水样品,1.0L样品中含4.8×10﹣2g Mg2+,那么该泉水中Mg2+的物质的量浓度为____________.含1.0mol Mg的这种泉水的体积是_________L.
(3)0.2mol H2S,在标准状况下的体积约为_______L;相同质量的CH4和H2S中分子个数比为____________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com