
【题目】现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽。用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中正确的是( )
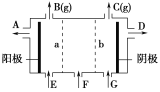
A.b是阳离子交换膜,允许Na+通过
B.从A口出来的是NaOH溶液
C.阴极反应式为4OH--4e-=2H2O+O2↑
D.Na2SO4溶液从F口加入
【答案】AD
【解析】
电解饱和Na2SO4溶液时,阳极附近是OH-放电,生成氧气,阴极附近时H+放电生成氢气,由于装置中放置了离子交换膜,在两极分别生成NaOH和H2SO4,需在阳极室一侧放置阴离子交换膜,只允许通过阴离子,在阴极一侧放置阳离子交换膜,只允许通过阳离子,接电源正极的是阳极,即B放出氧气,C生成氢气,以此解答该题。
A. 阴极生成氢气和OH-,在阴极一侧放置阳离子交换膜,只允许通过阳离子,生成NaOH,故A正确;
B. A为阳极,氢氧根离子放电产生的气体是氧气,同时生成氢离子,则阳极附近生成硫酸,则从A口出来的是H2SO4溶液,故B错误;
C. 阴极附近时H+放电生成氢气,反应式为2H++2e-═H2↑,故C错误;
D. NaOH在阴极附近生成,硫酸在阳极生成,则Na2SO4溶液从F口加入,故D正确;
故选AD。


科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.18g重水(D2O)所含电子的数目为10NA
B.6.4gS2、S4、S6的混合物中所含硫原子的数目为0.2NA
C.标准状况下,2.24LHF中分子的数目为0.1NA
D.60g乙酸与足量乙醇发生酯化反应时断裂C—O键的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应的化学方程式正确的是 ( )
A.CH3CH2Br+NaOH![]() CH2=CH2↑+NaBr+H2O
CH2=CH2↑+NaBr+H2O
B.2 ![]() + 3Br2 → 2
+ 3Br2 → 2 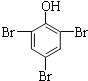 ↓
↓
C.nCH2=CH-CH3![]()
![]()
D.CH3CHO+2Ag(NH3)2OH![]() 2Ag↓+CH3COONH4+3NH3+H2O
2Ag↓+CH3COONH4+3NH3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为常见的有机物,在一定条件下,它们有如图所示的转化关系:

其中M(C)> M(B)> M(A)(M表示摩尔质量)。请根据图回答:
(1)不溶于水的物质是(填字母)_______________。
(2)能使紫色石蕊试液变红的物质是(填名称)_________。
(3)属于还原反应的是(填序号)___________________。
(4)写出D与水反应生成B和C的化学方程式(有机物用结构简式表示)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能。乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水。下列说法中不正确的是 ( )。

A.装置乙的a极要与装置甲的X极连接
B.装置乙中b极的电极反应式为2Cl--2e-=Cl2↑
C.若有机废水中主要含有葡萄糖,则装置甲中M极发生的电极应为C6H12O6+6H2O-24e-=6CO2↑+24H+
D.N电极发生还原反应,当N电极消耗5.6 L(标准状况下)气体时,则有2NA个H+通过离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的装置中,通电5min后,铜电极的质量增加2.16g。试回答下列问题:
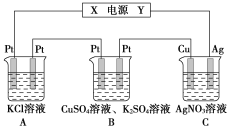
(1)电源中X极为直流电源的__极。
(2)溶液pH的变化情况:A__,B__,C__(填“增大”“减小”或“不变”)。
(3)通电5min后,B装置中共收集224mL(标准状况下)气体,溶液体积为200mL,则通电前该装置溶液中CuSO4的物质的量浓度为__(设电解前后溶液体积无变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A 的产量可以用来衡量一个国家的石油化工发展水平,E 是一种具有果香味的有机物(过程中的水或其他物质已省略)。
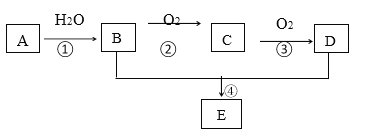
(1)D 分子中的官能团名称是_____。
(2)写出 C 的结构简式:_____
(3)反应①A→B 的反应类型是_____
(4)写出下列反应的化学方程式:B+D→E:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答问题:
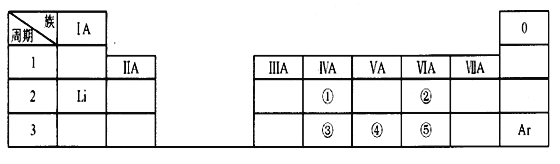
(1)①的元素符号是_________;
(2)②的原子结构示意图是_________;
(3)①和③的原子半径大小关系是:①____③(填“>”、“<”或“=”);
(4)③、④和⑤中,最高价氧化物对应的水化物酸性最强的酸的化学式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钼(![]() )在工业和国防建设中有重要的作用。钼的常见化合价为
)在工业和国防建设中有重要的作用。钼的常见化合价为![]() 。由钼精矿(主要成分是
。由钼精矿(主要成分是![]() )制备单质钼和钼酸钠晶体(
)制备单质钼和钼酸钠晶体(![]() ),部分流程如下图所示:
),部分流程如下图所示:
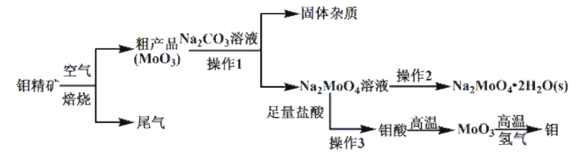
已知:钼酸微溶于水,可溶于碱溶液。
回答下列问题:
(1)钼精矿在空气中焙烧时,发生的主要方程式为_______________________。
(2)钼精矿焙烧时排放的尾气对环境会产生危害,请你提出一种实验室除去该尾气的方法________________________。
(3)操作2的名称为_________________________________。
(4)实验室由钼酸经高温制![]() ,所用到的硅酸盐材料仪器的名称是____________________________。
,所用到的硅酸盐材料仪器的名称是____________________________。
(5)操作1中,加入碳酸钠溶液充分反应后,碱浸液中![]() 、
、![]() ,在结晶前需加入
,在结晶前需加入![]() 固体以除去溶液中的
固体以除去溶液中的![]() 。当
。当![]() 开始沉淀时,
开始沉淀时,![]() 的去除率是_________。[
的去除率是_________。[![]() 、
、![]() ,溶液体积变化可忽略不计]
,溶液体积变化可忽略不计]
(6)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(![]() )。
)。
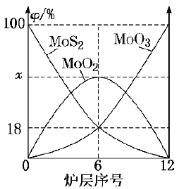
①![]() ___________。
___________。
②焙烧炉中也会发生![]() 与
与![]() 反应生成
反应生成![]() 和
和![]() ,还原剂为_________。若反应中转移
,还原剂为_________。若反应中转移![]() ,则消耗的还原剂的物质的量为______________。
,则消耗的还原剂的物质的量为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com