
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答问题:
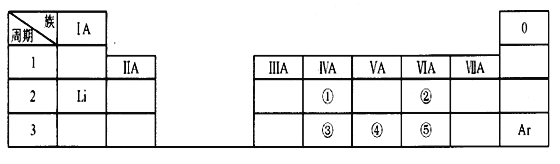
(1)①的元素符号是_________;
(2)②的原子结构示意图是_________;
(3)①和③的原子半径大小关系是:①____③(填“>”、“<”或“=”);
(4)③、④和⑤中,最高价氧化物对应的水化物酸性最强的酸的化学式是____________。
【答案】C ![]() < H2SO4
< H2SO4
【解析】
从元素周期表中可知,①为C;②为O;③为Si;④为P;⑤为S。
(1)①位于第二周期第ⅣA族,为碳元素,其符号为C;故答案为:C;
(2)②位于第二周期第ⅥA族,为氧元素,其原子结构示意图为:![]() ,故答案为:
,故答案为:![]() ;
;
(3)①为碳元素,③为硅元素,位于同一主族,根据同一主族元素,从上到下,原子半径增大,其原子半径大小关系是:r(C)<r(Si),故答案为:<;
(4)③为Si、④为P、⑤为S,其最高价氧化物对应的水化物分别为:H2SiO3、H3PO4、H2SO4,同一周期,从左到右,最高价氧化物对应的水化物酸性增强,所以最强的酸为:H2SO4,故答案为:H2SO4。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】化学是一门实用性很强的科学。根据题意填空:
(1)古代锻造刀剑时,将炽热的刀剑快速投入水中“淬火”,反应为:3Fe+4H2O(g) ![]() Fe3O4+4H2。该反应中H2O作__________(填“氧化剂”或“还原剂”);
Fe3O4+4H2。该反应中H2O作__________(填“氧化剂”或“还原剂”);
(2)某同学炒菜时发现,汤汁溅到液化气的火焰上时,火焰呈黄色。据此他判断汤汁中含有________(填“钠”或“钾”)元素;
(3)海水提镁的重要步骤之一是用沉淀剂将海水中的Mg2+沉淀。该沉淀剂是__________(填“生石灰”或“盐酸”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽。用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中正确的是( )
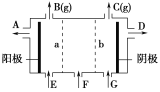
A.b是阳离子交换膜,允许Na+通过
B.从A口出来的是NaOH溶液
C.阴极反应式为4OH--4e-=2H2O+O2↑
D.Na2SO4溶液从F口加入
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是当今世界上最重要的化工产品之一,广泛应用于工业各个方面。硫酸的生产工艺几经改进,目前工业上主要采用接触法制备硫酸。接触室中发生如下反应:2SO2+O2![]() 2SO3。
2SO3。
(1)上述生成SO3的反应属于__________
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
(2)该反应是氧化还原反应,下列说法正确的是__________
A.SO2是氧化剂
B.O2发生氧化反应
C.O2失去电子
D.SO3既是氧化产物又是还原产物
(3)该反应也是放热反应,下列说法不正确的是__________
A.形成SO3中的硫氧键放出能量
B.断开SO2中的硫氧键放出能量
C.反应物的总能量大于生成物的总能量
D.放热反应的逆反应一定是吸热反应
(4)下列关于该反应的说法中,正确的是__________
A.增大接触室内炉气的压强对化学反应速率无影响
B.升高温度能加快反应速率
C.添加催化剂对反应速率无影响
D.增大O2的浓度能使SO2完全转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,互为同分异构体的是
A. O2和O3
B. CH3CH3和CH2=CH2
C. ![]() 和
和
D. CH3CH2CH2CH2 CH3和(CH3)2CH CH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池能够实现千余次充放电,但长时间使用后电池会失效,其中的化学试剂排放至环境中不仅会造成环境污染,还会造成资源的浪费。实验室模拟回收锂离子电池中的Co、Ni、Li的流程如图。
已知:LiCoO2难溶于水,易溶于酸。回答下列问题:
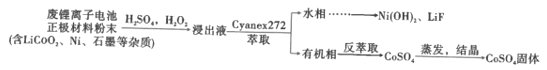
(1)LiCoO2中Co的化合价是__。
(2)LiCoO2在浸出过程中反应的离子方程式是__。
(3)浸出剂除了H2O2外,也可以选择Na2S2O3,比较二者的还原效率H2O2__(填“>”或“<”)Na2S2O3(还原效率:还原等物质的量的氧化剂消耗还原剂的物质的量)。
(4)提高浸出效率的方法有__。
(5)利用Cyanex272萃取时,pH对钴、镍萃取分离效果的影响如图。从图中数据可知,用Cyanex272萃取分离时,最佳pH是__。
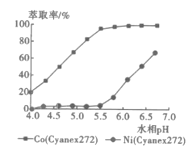
(6)反萃取的离子方程式为2H++CoR2=Co2++2HR,则反萃取剂的最佳选择是__。
(7)常温下,若水相中的Ni2+的质量浓度为1.18g·L-1,则pH=__时,Ni2+开始沉淀。[Ksp(Ni(OH)2=2×10-15]
(8)参照题中流程图的表达,结合信息设计完成从水相中分离Ni和Li的实验流程图(如图)___。
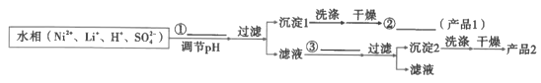
已知:
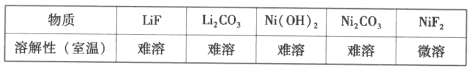
提供的无机试剂:NaOH、Na2CO3、NaF。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料的过程。水煤气生产原理为:C(s)+H2O(g)![]() CO(g)+H2(g)-131.3kJ。
CO(g)+H2(g)-131.3kJ。
(1)该反应的平衡常数K的表达式__;温度升高,K值__(填“变大”、“不变”或“变小”)。
(2)一定温度下,在一个容积不变的密闭容器中进行水煤气的生产反应,下列能判断该反应达到化学平衡状态的是__。
A.容器内压强不变 B.容器内气体密度不变
C.v(CO)=v(H2O) D.c(CO)=c(H2)
(3)如反应的容器容积为1.0L,反应时间为5.0min,容器内气体密度增大了0.12g/L,在这段时间内CO的平均反应速率为__。
(4)研究表明:在使用等质量催化剂时,增大催化剂的表面积可提高化学反应速率,为了分别验证温度,催化剂的表面积对化学反应速率的影响规律,至少应该设计__个实验。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都为短周期元素,A的核外电子数和周期数相等;B的+1价阳离子和C的―1价阴离子都与氖原子具有相同的电子层结构;D在C的下一周期,可与B形成BD型离子化合物;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸。请根据以上信息回答下列问题。
(1)B元素在元素周期表中的位置是第___周期___族。
(2)画出D元素的原子结构示意图___,E元素形成的分子的电子式___。
(3)与E的氢化物分子所含电子总数相等的分子是___(举一例、填化学式,下同),离子是___。
(4)A与C形成的化合物中含有化学键的类型是___。
(5)D的单质与B的最高价氧化物对应的水化物的溶液发生反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
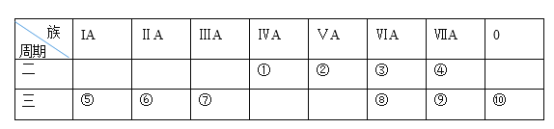
(1)非金属性最强的元素是______(填元素符号,下同),形成化合物种类最多的元素是________________________。
(2)第三周期元素除⑩外原子半径最小的是______(填元素符号),
(3)这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________。
(4)⑤、⑧两种元素的最高价氧化物对应的水化物相互反应的离子方程式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com