
����Ŀ����1��һ�������к���0.194g��������ʽC8H10N4O2��M=194g/mol������֪��������_______����������ӣ���Щ����������е�Nԭ�ӵ����ʵ���Ϊ_________��
��2�������һƿȪˮ��Ʒ��1.0L��Ʒ�к�4.8��10��2g Mg2+����ô��Ȫˮ��Mg2+�����ʵ���Ũ��Ϊ____________����1.0mol Mg������Ȫˮ�������_________L��
��3��0.2mol H2S���ڱ�״���µ����ԼΪ_______L����ͬ������CH4��H2S�з��Ӹ�����Ϊ____________��
���𰸡�0.001NA 0.004mol 0.002mol/L 500L 4.48L 17��8
��������
�������ʵ�����������������������ʵ���Ũ�ȵ��������Ĺ�ϵ�������
��1��0.194g����������ʵ���Ϊ��![]() �����п�������ӵ���ĿΪ0.001NA��������ķ���ʽΪC8H10N4O2��ÿ������������к���4��N��Ӧ�У���ÿ���������к���N�����ʵ���Ϊ��0.001mol��4=0.004mol���ʴ�Ϊ��0.001NA��0.004mol��
�����п�������ӵ���ĿΪ0.001NA��������ķ���ʽΪC8H10N4O2��ÿ������������к���4��N��Ӧ�У���ÿ���������к���N�����ʵ���Ϊ��0.001mol��4=0.004mol���ʴ�Ϊ��0.001NA��0.004mol��
��2��4.8��10-2g![]() ��Mg2+�����ʵ���Ϊ��
��Mg2+�����ʵ���Ϊ��![]() ����1.0mol Mg2+������Ȫˮ�����Ϊ��
����1.0mol Mg2+������Ȫˮ�����Ϊ��![]() ���ʴ�Ϊ��0.002mol/L��500L��
���ʴ�Ϊ��0.002mol/L��500L��
��3����״����0.2molH2S�����Ϊ��22.4L/mol��0.2mol=4.48L����ͬ������CH4��H2S�����ʵ�����Ħ�������ɷ��ȣ�������Ӹ�����=���ʵ���֮��=34g/mol��16g/mol=17��8���ʴ�Ϊ��4.48L��17��8��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������⣨![]() ���ڹ�ҵ��������������Ҫ�����á���ij������ϼ�Ϊ
���ڹ�ҵ��������������Ҫ�����á���ij������ϼ�Ϊ![]() �����⾫����Ҫ�ɷ���
�����⾫����Ҫ�ɷ���![]() ���Ʊ�������������ƾ��壨
���Ʊ�������������ƾ��壨![]() ����������������ͼ��ʾ��
����������������ͼ��ʾ��
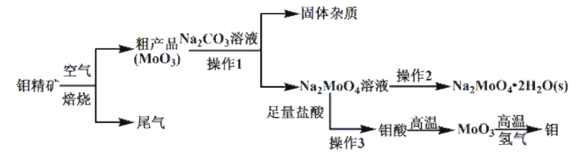
��֪����������ˮ�������ڼ���Һ��
�ش��������⣺
(1)�⾫���ڿ����б���ʱ����������Ҫ����ʽΪ_______________________��
(2)�⾫����ʱ�ŷŵ�β���Ի��������Σ�����������һ��ʵ���ҳ�ȥ��β���ķ���________________________��
(3)����2������Ϊ_________________________________��
(4)ʵ���������ᾭ������![]() �����õ��Ĺ����β���������������____________________________��
�����õ��Ĺ����β���������������____________________________��
(5)����1�У�����̼������Һ��ַ�Ӧ���Һ��![]() ��
��![]() ���ڽᾧǰ�����
���ڽᾧǰ�����![]() �����Գ�ȥ��Һ�е�
�����Գ�ȥ��Һ�е�![]() ����
����![]() ��ʼ����ʱ��
��ʼ����ʱ��![]() ��ȥ������_________��[
��ȥ������_________��[![]() ��
��![]() ����Һ����仯�ɺ��Բ���]
����Һ����仯�ɺ��Բ���]
(6)�����⾫�����õ�װ���Ƕ�㱺��¯��ͼ2Ϊ��¯��������ϵ����ʵ����İٷ�����![]() ����
����
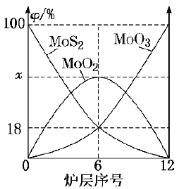
��![]() ___________��
___________��
������¯��Ҳ�ᷢ��![]() ��
��![]() ��Ӧ����
��Ӧ����![]() ��
��![]() ����ԭ��Ϊ_________������Ӧ��ת��
����ԭ��Ϊ_________������Ӧ��ת��![]() �������ĵĻ�ԭ�������ʵ���Ϊ______________��
�������ĵĻ�ԭ�������ʵ���Ϊ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������һ�ֳ�����ǿ�����������������������ƽ���������������Ϣ�ش�����:
��֪:�ٸ���������ȷֽ�ΪN2��Cl2��O2��H2O;��Mg3N2��ˮ��;��Cu��N2�ھƾ��Ƽ��������²���Ӧ��
��1��д������������ȷֽ�Ļ�ѧ��Ӧ����ʽ: _____________��Mg3N2�ĵ���ʽΪ________��
��2������23.5g NH4ClO4�ֽ⣬������װ�����ʵ�飬��֤��ֽ���ﲢ����ֽ��ʡ�(ע:��װ���п����ѳ���;��װ�ÿ��ظ�ʹ��;��B~Fװ���е��Լ���������������Ӧ���ʷ�Ӧ��ȫ��)
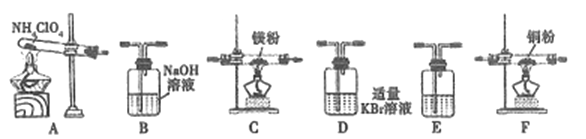
����Eװ����������������֤���ɵ��������֮һ����E��ʢ�ŵ��Լ���:_______��
���밴�����������ҵķ�������װ��:A ��E��D ��B��______��_____��_______��E (ѡ��B~Fװ�ã�����B~F��ĸ���)��
��֤����������Cl2��ʵ������:________��
�ܷ�Ӧ��������Cװ������������2.38g����NH4ClO4�ķֽ�����:________%��
��3����Ʒ��NH4ClO4�ĺ���(�����в���NH4+)���������ⶨ(��ͼ��ʾ�����Ⱥͼг�װ������ȥ)��ʵ�鲽������:

����1:��װ���������������;ȷ��ȡ��Ʒa g(������0.5g)��������ƿ�У�����Լ150mLˮ�ܽ⡣
����2:ȷ��ȡ40.00mL Լ0.1mol/L H2SO4����ƿ�С�
����3:��������ƿ�м���20mL 3mol/L NaOH��Һ;��������ʹNH3ȫ���ӷ���
����4:������й���ˮ��ϴ����װ��2~3�Σ�ϴ��Һ������ƿ�С�
����5:����ƿ�м�2~3�μ��ȣ���c mol/L NaOH����Һ�ζ����յ㣬����NaOH����ҺV1 mL��
����6:�ظ�ʵ��2~3�Ρ�
�ش���������:
�ٲ���2�У�ȷ��ȡ40.00ml H2SO4 ��Һ�IJ���������: __________��
��Ϊ�����Ʒ��NH4ClO4�ĺ��������貹���ʵ����:______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȼ��ʱ�õ�һ�ֱ��������ᄃ�壬�侧���Ľṹ��ͼ��ʾ�������й�˵������ȷ����
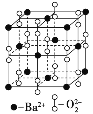
A. �þ����������Ӿ���
B. ����Ļ�ѧʽΪBa2O2
C. �þ���ľ����ṹ��CsCl����
D. ��ÿ��Ba2+��������������Ba2+����12��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������±������KOH����Һ�м��Ȳ�������ȥ��Ӧ���ǣ� ��
��![]() ��
��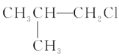 ��(CH3)3CCH2Cl ��CHCl2-CHBr2 ��
��(CH3)3CCH2Cl ��CHCl2-CHBr2 ��![]() ��CH3Cl
��CH3Cl
A.�٢ۢ�B.�ڢۢ�C.ȫ��D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ�������,��������Һ���ڵ���ⲿ����,���ڵ����,��ά�ֵ���ڲ��������ҺŨ���ȶ������й��ڸõ�ص�˵���������
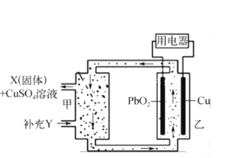
A.CuΪ�õ�صĸ���
B.XΪPbSO4,YΪH2SO4
C.������1 mol PbO2,������320 g CuSO4
D.PbO2�缫��ӦʽΪPbO2+4H+ + SO42- +2e-=PbSO4+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ǽ�����Methylnene Blue���ڼ��������������������������Ǽ��ף�Methylene White�����Ǽ����Ľṹ��ʽ��
��������ƿ��ʵ������������£�
����ͼʾ��250mL��ƿ�У����μ���2g NaOH��100mL H2O��3g�����ǣ������ܽ���ټ���3�Ρ�5��0.2%���Ǽ�����Һ�����Һ������ɫ��
��������Ƥ��������a��b�رգ�������Һ���ã���Һ��Ϊ��ɫ��
���ٴ�ƿ��������Һ�ֱ�Ϊ��ɫ��
����������Ƥ��������Һ���ã���Һ�ֱ�Ϊ��ɫ�����Ϣۡ��ܿ��ظ���Ρ�
�Իش��������⣺

��1��ijѧ���������õ���ɫ��Һ��װ��A��B��֧�Թ��У�����ͼ��A�Թܳ�����Һ��B����������Һ����������Ƥ������Ƭ�̣�����Һ������ɫ������ͬʱ��A��B�Թܣ�������ɫ����_________������A������B������
��2����������ƿ��������a��b��ͨ�������������ٹرջ���a��b������Һ�ܷ�����ɫ��Ϊ��ɫ_________��������������������������������ƿ������a��bͨ��������������Һ�ܷ�����ɫ��Ϊ��ɫ_________������������������������
��3������ת�������У������ǵ�������_________���Ǽ�����������_________��
��4������ʵ����������Ҳ�����ʳ�֭�����к��ḻά����C�����棬������Ϊά����C����_____��
��5����ʵ���Тۡ��ܲ����ܷ������ظ�����_________�����������������������������ǡ�_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�����A��B�����2 L���ܱ������У��������з�Ӧ2A(g) + B(g) ![]() xC(g) + 2D(g)����4min���ƽ�⣬���D��Ũ��Ϊ1.0 mol��L��1��c(A) : c(B)��2 : 3����C��ʾ��ƽ��������(C)��0.125 mol��L��1��min��1������˵������ȷ����
xC(g) + 2D(g)����4min���ƽ�⣬���D��Ũ��Ϊ1.0 mol��L��1��c(A) : c(B)��2 : 3����C��ʾ��ƽ��������(C)��0.125 mol��L��1��min��1������˵������ȷ����
A. ��Ӧ������(A)��0.25 mol��L��1��min��1
B. �÷�Ӧ����ʽ�У�x��1
C. 4 minʱ��B�����ʵ���Ϊ2 mol
D. �÷�Ӧ��ƽ�ⳣ��K��1/3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��O3��һ�ֳ�������ɫ�����������ɳ�����������ԭ����ͼ�����ϡ�����Ƶá�����˵��������ǣ� ��
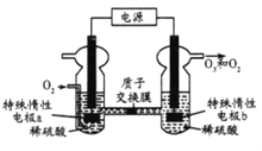
A.�缫aΪ����
B.a���ĵ缫��ӦΪO2+4H++4e-�T2H2O
C.���һ��ʱ���b����Χ��pH����
D.��״���£�����5.6LO2��Ӧʱ���ռ���O2��O3�������4.48L��O3���������Ϊ80%
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com