
【题目】钠、镁、铝、铁是四种重要的金属。请回答:
(1)钠的金属活动性比铝的________(填“强”或“弱”)。
(2)钠与水反应,可观察到的实验现象是________(填编号)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(3)Fe跟Cl2在一定条件下反应,所得产物的化学式是________。
(4)写出铁与水蒸气在高温时反应的化学方程式____________
(5)将镁铝合金与过量NaOH溶液反应,所得溶液中不存在的离子是________。
A.Na+ B.Mg2+ C.OH- D.AlO2-
(6)将镁铝合金溶于过量的盐酸中,充分反应后,溶液中新生成的离子是________。
【答案】强 bc FeCl3 3Fe+4H2O(g)![]() Fe3O4+4H2 B Mg2+、Al3+
Fe3O4+4H2 B Mg2+、Al3+
【解析】
⑴根据金属活动顺序表得出钠的金属活动性比铝的强,
故答案为强;
⑵钠与水反应,可观察到现象为浮、熔、游、响,
故答案为bc;
⑶Fe跟Cl2反应,无论过量少量都只生成氯化铁,
故答案为FeCl3;
⑷铁与水蒸气在高温时反应生成四氧化三铁和氢气,其化学方程式3Fe+4H2O(g)![]() Fe3O4+4H2,
Fe3O4+4H2,
故答案为3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
⑸将镁铝合金与过量NaOH溶液反应,只有铝和氢氧化钠反应生成偏铝酸钠和氢气,镁不反应,还剩余氢氧化钠,因此不存在的离子是镁离子,
故答案为B;
⑹将镁铝合金溶于过量的盐酸中,镁与盐酸反应生成氯化镁和氢气,铝和盐酸反应生成氯化铝和氢气,因此溶液中新生成的离子是镁离子和铝离子,
故答案为Mg2+、Al3+


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)现有下列物质 ①NaCl晶体②液态SO2 ③纯醋酸 ④硫酸钡⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KNO3 ⑧NaOH溶液 ⑨氨水 请用以上物质的序号回答下列问题:
属于强电解质的是________; 属于弱电解质的是_______;在上述状态下能导电的物质是_________。
(2)化学平衡移动原理同样也适用于其它平衡,已知在氨水中存在下列平衡:NH3·H2O ![]() NH4++OH-
NH4++OH-
①向氨水中加入NH4Cl固体时,平衡____________移动,(填“向右”或“向左”),c(OH-)____(填“增大”或“减小”,下同)。
②向氨水中加入MgCl2固体时,平衡_____移动,(填“向右”或“向左”), c(NH4+)____(填“增大”或“减小”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解硫酸钠溶液生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,以下说法正确的是( )

A. a极与电源的负极相连
B. a电极反应式:2H2O+2e-= H2↑+2OH-
C. 离子交换膜d为阴离子交换膜
D. 产物丙为硫酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若m g Na在足量氯气中燃烧,生成固体的质量为(m+3.55) g,则m g Na与氧气反应,生成固体的质量可能为( )
①(m+0.8) g ②(m+1.0) g ③(m+1.2) g ④(m+1.6) g ⑤(m+1.8) g
A.仅①④B.仅①⑤
C.①②③④D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。下列判断正确的是( )

A. 滤纸上c点附近会变红色
B. Cu电极质量减小,Pt电极质量增大
C. Z中溶液的pH先减小,后增大
D. 溶液中的SO42-向Cu电极定向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源与材料、信息一起被称为现代社会发展的三大支柱。面对能源枯竭的危机,提高能源利用率和开辟新能源是解决这一问题的两个主要方向。
(1)化学反应速率和限度与生产、生活密切相关,这是化学学科关注的方面之一。某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水法收集反应放出的氢气,实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL(标况) | 100 | 240 | 464 | 576 | 620 |
①哪一段时间内反应速率最大:__________min(填“0~1”“1~2”“2~3”“3~4”或“4~5”)。
②另一学生为控制反应速率防止反应过快难以测量氢气体积。他事先在盐酸中加入等体积的下列溶液以减慢反应速率但不影响生成氢气的量。你认为可行的是____________(填字母序号)。
A.KCl溶液 B.浓盐酸 C.蒸馏水 D.CuSO4溶液
(2)如图为原电池装置示意图:

①将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是_______(填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入浓硝酸溶液中形成的原电池的负极反应式:_______________。
②若A为Cu,B为石墨,电解质为FeCl3溶液,工作时的总反应为2FeCl3+Cu=2FeCl2+CuCl2。写出B电极反应式:________;该电池在工作时,A电极的质量将_____(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1mol FeCl3,则转移电子的数目为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分。X、Y、Z、W 均为短周期元素,若W原子最外层电子数是其内层电子数的 ![]() ,则下列说法不正确的是( )
,则下列说法不正确的是( )
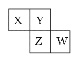
A.X 元素的氢化物分子间可以形成氢键
B.Y 元素的两种同素异形体常温下都是气体
C.最高价氧化物对应水化物的酸性:W>Z
D.阴离子半径从大到小排列顺序为:X>Y>Z>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈(Ce)是一种重要的稀土元素。以富含CeO2的废玻璃粉末(含SiO2、 Fe2O3以及其他少量可溶于稀酸的杂质)为原料,采用多种方法回收铈。请回答下列问题:
(1)湿法空气氧化法回收铈的部分流程如下:

已知:CeO2不溶于稀盐酸,也不溶于NaOH溶液。
滤渣的成分是________,反应②的离子方程式是________。
(2)干法空气氧化法回收铈是把Ce(OH)3被空气氧化成Ce(OH)4,氧化过程中发生的化学反应方程式为________。两种制备Ge(OH)4的数据如下表:
干法空气氧化法 | 氧化温度/℃ | 氧化率/% | 氧化时间/h |
暴露空气中 | 110120 | 90 | 18 |
在对流空气氧化炉中 | 110120 | 99 | 8 |
在对流空气氧化炉中大大缩短氧化时间的原因是________。
(3)利用电解方法也可以实现铈的回收。
①在酸性条件下电解Ce2O3 (如图):阳极电极反应式为______,离子交换膜为______ (填“阴”或“阳”)离子交换膜。
②电解产物Ce(SO4)2是重要的氧化剂,将其配成标准溶液,在酸性条件下能测定工业盐中NaNO2的含量,写出发生反应的离子方程式_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气的反应化学方程式如下:(用元素符号或化学式表示)
MnO2+4HCl(浓)= MnCl2+Cl2↑+2H2O
(1)还原剂是:______;氧化产物是 _________;
(2)被氧化的原子与被还原的原子个数之比为____
(3)请用双线桥法表示反应的电子转移方向和数目
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com