
【题目】如图是元素周期表的一部分。X、Y、Z、W 均为短周期元素,若W原子最外层电子数是其内层电子数的 ![]() ,则下列说法不正确的是( )
,则下列说法不正确的是( )
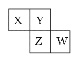
A.X 元素的氢化物分子间可以形成氢键
B.Y 元素的两种同素异形体常温下都是气体
C.最高价氧化物对应水化物的酸性:W>Z
D.阴离子半径从大到小排列顺序为:X>Y>Z>W
【答案】D
【解析】
X、Y、Z、W均为短周期元素,若W原子最外层电子数是其内层电子数的![]() ,则W原子其内层电子总数为10,最外层电子数为7,故W是Cl元素;由X、Y、Z、W在周期表中的位置关系可知,Z为S元素;Y为O元素;X为N元素。根据元素所在周期表中的位置,结合元素周期律的递变规律进行判断。
,则W原子其内层电子总数为10,最外层电子数为7,故W是Cl元素;由X、Y、Z、W在周期表中的位置关系可知,Z为S元素;Y为O元素;X为N元素。根据元素所在周期表中的位置,结合元素周期律的递变规律进行判断。
根据分析X为N元素;Y为O元素;Z为S元素;W是Cl元素。
A.X为N元素,其氢化物NH3,其分子之间存在氢键,正确,A不选;
B.Y为O元素;Y元素的两种同素异形体为O2和O3,在常温下都是气体,正确,B不选;
C.同周期元素从左到右元素的非金属性逐渐增强,所以非金属性W>Z;元素的非金属性越强,对应最高价氧化物的水化物的酸性越强,所以最高价氧化物对应水化物的酸性:W>Z,正确,C不选;
D.当核外电子排布相同,核电荷数越大,离子半径越小,所以离子半径X>Y,Z>W;一般来说,电子层越多半径越大,所以W>X,所以阴离子半径由大到小排列顺序Z>W>X>Y,错误,D选。
答案选D。


科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。

请回答下列问题:
Ⅰ.(1)步骤1中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中要使用Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式_________________。
(2)海水提溴,制得1mol Br2需要消耗_________ mol Cl2。步骤Ⅱ中需要向母液中加入稀硫酸酸化,其作用是___________________________。步骤Ⅲ若用Na2SO3水溶液吸收Br2,有关反应的离子方程式为_______________________________。
(3)为了从工业Br2中提纯溴,除去产物中残留的少量Cl2,可向其中加入__________溶液。
Ⅱ.(1)Mg在元素周期表中的位置:_____________,Mg(OH)2的电子式:____________,Mg(OH)2中所含元素的简单离子半径由小到大的顺序是____________________________。
(2)步骤Ⅳ由Mg(OH)2得到单质Mg,以下方法最合适的是_______________(填序号)。
A.Mg(OH)2![]() MgCl2
MgCl2 ![]() Mg B. Mg(OH)2
Mg B. Mg(OH)2![]() MgO
MgO![]() Mg
Mg
C. Mg(OH)2![]() MgO
MgO ![]() Mg D. Mg(OH)2
Mg D. Mg(OH)2![]() 无水MgCl2
无水MgCl2 ![]() Mg
Mg
(3)判断Mg(OH)2是否洗涤干净的操作是__________________。
Ⅲ. 用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
 (R:烃基: R':烃基或H)依据上述信息,写出制备
(R:烃基: R':烃基或H)依据上述信息,写出制备![]() 所需溴代烃的可能结构简式: ___________。
所需溴代烃的可能结构简式: ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X是短周期元素中原子半径最小的,Y、W同主族,且Y、W的原子序数之差与Z的原子序数相同,X、Y、Z、W的最外层电子数之和为15。下列说法错误的是
A. 原子半径:W>Y>Z
B. WY可用于制造高温结构陶瓷
C. Y2X4能使酸性高锰酸钾溶液褪色
D. Y单质与WZ2在高温条件下反应生成W单质,说明非金属性:Y>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、镁、铝、铁是四种重要的金属。请回答:
(1)钠的金属活动性比铝的________(填“强”或“弱”)。
(2)钠与水反应,可观察到的实验现象是________(填编号)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(3)Fe跟Cl2在一定条件下反应,所得产物的化学式是________。
(4)写出铁与水蒸气在高温时反应的化学方程式____________
(5)将镁铝合金与过量NaOH溶液反应,所得溶液中不存在的离子是________。
A.Na+ B.Mg2+ C.OH- D.AlO2-
(6)将镁铝合金溶于过量的盐酸中,充分反应后,溶液中新生成的离子是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清华大学王晓琳教授首创三室棋电解法制备LiOH,其工作原理如图所示,下列有关说法正确的是( )

A. X电极连接电源负极
B. Y电极反应式为 O2+2H2O+4e-=4OH-
C. N为阳离子交换膜
D. 制备2.4g LiOH产生的H2在标准状况下为2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有Fe和Cu的混合物24g,与足量的稀盐酸反应共放出H26.72L(标准状况),求:
(1)原混合物中Fe的物质的量是多少?___
(2)原混合物中Fe的质量分数?___
(3)反应中消耗HCl物质的量是多少?___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛的应用。如图所示为一电解池装置,U形管内装有电解液c,A、B是两块电极板,通过导线与直流电源相连。

(1)若A、B都是惰性电极,电解质溶液c是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试剂,试判断:
①a电极是_____极(填“正”或“负”),B电极是_____极(填“阴”或“阳”);
②A电极产生的气体为________,B电极上的电极反应式为______________;
③检验A电极上产物的方法是:_________________。
(2)若图示装置为用惰性电极电解CuSO4溶液的装置,其中阴极上析出Cu的质量为3.2 g,常温下,若将电解后的溶液稀释至1 L,则溶液的pH约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应mA(g)+nB(s)![]() pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强P的关系如图所示,请判断下列说法正确的是 ( )
pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强P的关系如图所示,请判断下列说法正确的是 ( )

A.降温,化学平衡向逆反应方向移动
B.使用催化剂可使D%有所增加
C.化学方程式中气体的化学计量数m<p+q
D.B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的有___个( )
①用电子式表示MgCl2的形成过程为:![]()
②两个不同种非金属元素的原子间形成的化学键都是极性键
③离子化合物在熔融状态时能够导电
④含有非极性键的化合物一定是共价化合物
⑤元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
⑥次氯酸的电子式:![]()
⑦离子化合物中一定含有离子键
A.1B.2C.3D.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com