
【题目】海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。

请回答下列问题:
Ⅰ.(1)步骤1中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中要使用Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式_________________。
(2)海水提溴,制得1mol Br2需要消耗_________ mol Cl2。步骤Ⅱ中需要向母液中加入稀硫酸酸化,其作用是___________________________。步骤Ⅲ若用Na2SO3水溶液吸收Br2,有关反应的离子方程式为_______________________________。
(3)为了从工业Br2中提纯溴,除去产物中残留的少量Cl2,可向其中加入__________溶液。
Ⅱ.(1)Mg在元素周期表中的位置:_____________,Mg(OH)2的电子式:____________,Mg(OH)2中所含元素的简单离子半径由小到大的顺序是____________________________。
(2)步骤Ⅳ由Mg(OH)2得到单质Mg,以下方法最合适的是_______________(填序号)。
A.Mg(OH)2![]() MgCl2
MgCl2 ![]() Mg B. Mg(OH)2
Mg B. Mg(OH)2![]() MgO
MgO![]() Mg
Mg
C. Mg(OH)2![]() MgO
MgO ![]() Mg D. Mg(OH)2
Mg D. Mg(OH)2![]() 无水MgCl2
无水MgCl2 ![]() Mg
Mg
(3)判断Mg(OH)2是否洗涤干净的操作是__________________。
Ⅲ. 用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
 (R:烃基: R':烃基或H)依据上述信息,写出制备
(R:烃基: R':烃基或H)依据上述信息,写出制备![]() 所需溴代烃的可能结构简式: ___________。
所需溴代烃的可能结构简式: ___________。
【答案】Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓ 2 抑制氯气和水反应 Br2+SO32-+H2O=SO42-+2H++2Br- NaBr 第三周期第ⅡA族 ![]() r(O2-)>r(Mg2+)>r(H+) D 取最后的洗涤液少量于试管中,向其中加入HNO3酸化的AgNO3溶液,如果没有沉淀生成,证明已洗净 CH3CH2Br、CH3Br
r(O2-)>r(Mg2+)>r(H+) D 取最后的洗涤液少量于试管中,向其中加入HNO3酸化的AgNO3溶液,如果没有沉淀生成,证明已洗净 CH3CH2Br、CH3Br
【解析】
I.(1)SO42-、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,碳酸钠一定在氯化钡之后;加入的Na2CO3溶液会与过量的BaCl2溶液、CaCl2溶液发生沉淀反应;
(2)根据Cl2与NaBr反应的方程式中关系分析、计算;结合氯气与水的反应是可逆反应分析;Na2SO3具有还原性,而Br2具有氧化性,二者发生氧化还原反应,根据电子守恒、原子守恒及电荷守恒书写离子方程式;
(3)可用溴化钠除去氯气;
Ⅱ.(1)根据Mg核外电子排布判断其在周期表中的位置;Mg(OH)2是离子化合物,Mg2+与2个OH-之间通过离子键结合;原子核外电子层数越多离子半径越大,当层数相同时,核电荷数越小,离子半径越大;
(2)制备氢氧化镁的过程为:海水中含有镁离子,首先将镁离子转化为氢氧化镁沉淀,反应方程式为:Mg2++2OH-=Mg(OH)2↓,然后将氢氧化镁溶于盐酸中得到氯化镁溶液,反应方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,用氯化镁溶液在氯化氢氛围中制取无水氯化镁,活泼金属采用电解其熔融盐的方法冶炼,镁是活泼金属,所以最后利用电解熔融氯化镁的方法冶炼镁。
(3) Mg(OH)2沉淀是从NaCl溶液中过滤出来的,只要在Mg(OH)2的最后洗涤溶液中无Cl-就可判断洗涤干净;
Ⅲ.使镁与CH3Br反应制成CH3MgBr然后与CH3CHO反应制取![]() ;也可以使Mg与CH3CH2Br反应制取CH3CH2MgBr,然后与甲醛HCHO发生反应制取得到
;也可以使Mg与CH3CH2Br反应制取CH3CH2MgBr,然后与甲醛HCHO发生反应制取得到![]() ,据此解答。
,据此解答。
(1)向含有Ca2+、Mg2+、SO42-等杂质离子的NaCl溶液中先加入过量BaCl2溶液除去SO42-,再加入过量Na2CO3溶液除去原溶液中含有的Ca2+及为除去SO42-而加入的过量的Ba2+,反应的离子方程式为:Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓;
(2)Cl2具有强的氧化性,在溶液中与Br-发生氧化还原反应:Cl2+2Br-=2Cl-+Br2,反应产生的Br2被含有SO2的溶液吸收,发生反应:Br2+2H2O+SO2=2HBr+H2SO4,通过该富集作用,然后向溶液中再通入氯气,发生反应,根据方程式可知:Cl2+2Br-=2Cl-+Br2,可见每反应制取1mol Br2需要消耗2molCl2;步骤Ⅱ中需要向母液中加入稀硫酸酸化,这是由于氯气溶于水,会与水发生反应,该反应是可逆反应:Cl2+H2O![]() H++Cl-+HClO,向该溶液中加入酸,增大c(H+),可使反应平衡逆向移动,从而可起到抑制氯气和水反应的作用。步骤Ⅲ若用Na2SO3水溶液吸收Br2,二者发生氧化还原反应,根据电子守恒、电荷守恒及原子守恒,可得有关反应的离子方程式为Br2+SO32-+H2O=SO42-+2H++2Br-;
H++Cl-+HClO,向该溶液中加入酸,增大c(H+),可使反应平衡逆向移动,从而可起到抑制氯气和水反应的作用。步骤Ⅲ若用Na2SO3水溶液吸收Br2,二者发生氧化还原反应,根据电子守恒、电荷守恒及原子守恒,可得有关反应的离子方程式为Br2+SO32-+H2O=SO42-+2H++2Br-;
(3)由于氧化性Cl2>Br2,为除去溴单质中少量的Cl2,可向其中加入溴化钠,氯气与溴化钠反应产生单质溴及NaCl,达到除去氯气的目的;
Ⅱ.(1) Mg是12号元素,在周期表中的位置是第三周期第ⅡA族;Mg(OH)2是离子化合物,Mg2+与2个OH-之间通过离子键结合,其电子式为![]() ;在Mg(OH)2中含有Mg、O、H三种元素,H+核外无电子,离子半径最小,Mg2+、O2-
;在Mg(OH)2中含有Mg、O、H三种元素,H+核外无电子,离子半径最小,Mg2+、O2-
(2) A.氯化镁中加入活泼的金属发生置换反应,由于Mg很活泼,比镁活泼的金属冶炼是采用电解方法,消耗大量电能,不经济,A错误;
B.氧化镁熔点高,要求设备条件高,消耗更多能源,不经济,B错误;
C.镁能在CO2中燃烧生成碳和氧化镁,镁是活泼金属,通常用电解的方法冶炼,不能用碳还原氧化镁制备,C错误;
D.在HCl的气氛中加热Mg(OH)2,二者反应产生MgCl2,同时也抑制了MgCl2的水解,利用电解熔融氯化镁的方法冶炼镁,反应方程式为:MgCl2![]() Mg+Cl2↑,D正确;
Mg+Cl2↑,D正确;
故合理选项是D。
(3) Mg(OH)2沉淀是从NaCl溶液中过滤出来的,若在洗涤Mg(OH)2沉淀的最后一次洗涤溶液中无Cl-就可判断洗涤干净;操作方法是:取最后的洗涤液少量于试管中,向其中加入HNO3酸化的AgNO3溶液,如果没有沉淀生成,证明已洗净;
III.使镁与CH3Br反应制成CH3MgBr然后与CH3CHO反应制取![]() ;也可以使Mg与CH3CH2Br反应制取CH3CH2MgBr,然后与甲醛HCHO发生反应制取得到
;也可以使Mg与CH3CH2Br反应制取CH3CH2MgBr,然后与甲醛HCHO发生反应制取得到![]() ,因此需要的溴代烃的可能结构简式为CH3CH2Br或CH3Br。
,因此需要的溴代烃的可能结构简式为CH3CH2Br或CH3Br。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】2019年是元素周期表诞生150周年,目前周期表七个周期均已排满,共118种元素。短周期元素W、X、Y、Z在周期表中的相对位置如图所示,且四种元素的原子最外层电子数之和为24。
下列说法不正确的是

A. 最高价氧化物对应水化物的酸性:Z>Y
B. W的氢化物与Z的氢化物反应,产物的水溶液呈碱性
C. 在元素周期表中,117号元素与Z元素位于同一主族
D. 工业上常用YX2漂白纸浆、毛、丝等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在含有大量PbI2的饱和溶液中存在平衡:PbI2(s)![]() Pb2+(aq)+2I-(aq),向该饱和溶液中加入KI浓溶液,下列说法正确的是
Pb2+(aq)+2I-(aq),向该饱和溶液中加入KI浓溶液,下列说法正确的是
A. 溶液中Pb2+和I-的浓度都增大 B. PbI2的溶度积常数Ksp增大
C. 沉淀溶解平衡向右移动 D. 溶液中Pb2+的浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列物质 ①NaCl晶体②液态SO2 ③纯醋酸 ④硫酸钡⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KNO3 ⑧NaOH溶液 ⑨氨水 请用以上物质的序号回答下列问题:
属于强电解质的是________; 属于弱电解质的是_______;在上述状态下能导电的物质是_________。
(2)化学平衡移动原理同样也适用于其它平衡,已知在氨水中存在下列平衡:NH3·H2O ![]() NH4++OH-
NH4++OH-
①向氨水中加入NH4Cl固体时,平衡____________移动,(填“向右”或“向左”),c(OH-)____(填“增大”或“减小”,下同)。
②向氨水中加入MgCl2固体时,平衡_____移动,(填“向右”或“向左”), c(NH4+)____(填“增大”或“减小”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,图甲是镁——次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含![]() 的工业废水的处理。下列说法正确的是( )
的工业废水的处理。下列说法正确的是( )

A. 图乙中![]() 向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
B. 图甲中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓
C. 图乙电解池中,若有0.84g阳极材料参与反应,则阴极会有3.36L的气体产生
D. 若图甲燃料电池消耗0.36g镁产生的电量用以图乙废水处理,理论上可产生1.07g氢氧化铁沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用碳酸钠晶体配制1.00mol/L的Na2CO3溶液100mL,造成所配溶液浓度偏高的原因是( )
A. 烧杯和玻璃棒没有洗涤
B. 向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤
C. 定容时俯视刻度线
D. 称量碳酸钠晶体(Na2CO310H2O)的烧杯未干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为测定未知浓度的盐酸溶液,实验如下:用1.00 mL待测盐酸配制100 mL稀盐酸,以0.10 mol/L的NaOH溶液滴定25.00 mL上述稀盐酸,滴定终止时消耗NaOH溶液15.00mL。
(1)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果______(填“偏大”、“偏小”或“无影响”,下同);若观察碱式滴定管读数时,滴定前仰视而滴定后俯视,则结果会导致测得的稀盐酸溶液浓度值_________。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入下图中的________(选填“甲”或“乙”);下图在滴定操作时,排去碱式滴定管中气泡的方法应采用操作______(选填“甲”、“乙”或“丙”),然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(3)配制100 mL一定浓度的稀盐酸溶液,除使用量筒、烧杯、玻璃棒、和胶头滴管外还需用到的仪器是______________,计算待测盐酸(稀释前的盐酸)溶液的物质的量浓度为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解硫酸钠溶液生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,以下说法正确的是( )

A. a极与电源的负极相连
B. a电极反应式:2H2O+2e-= H2↑+2OH-
C. 离子交换膜d为阴离子交换膜
D. 产物丙为硫酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分。X、Y、Z、W 均为短周期元素,若W原子最外层电子数是其内层电子数的 ![]() ,则下列说法不正确的是( )
,则下列说法不正确的是( )
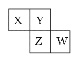
A.X 元素的氢化物分子间可以形成氢键
B.Y 元素的两种同素异形体常温下都是气体
C.最高价氧化物对应水化物的酸性:W>Z
D.阴离子半径从大到小排列顺序为:X>Y>Z>W
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com