
【题目】清华大学王晓琳教授首创三室棋电解法制备LiOH,其工作原理如图所示,下列有关说法正确的是( )

A. X电极连接电源负极
B. Y电极反应式为 O2+2H2O+4e-=4OH-
C. N为阳离子交换膜
D. 制备2.4g LiOH产生的H2在标准状况下为2.24 L
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,图甲是镁——次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含![]() 的工业废水的处理。下列说法正确的是( )
的工业废水的处理。下列说法正确的是( )

A. 图乙中![]() 向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
B. 图甲中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓
C. 图乙电解池中,若有0.84g阳极材料参与反应,则阴极会有3.36L的气体产生
D. 若图甲燃料电池消耗0.36g镁产生的电量用以图乙废水处理,理论上可产生1.07g氢氧化铁沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家开发出Na-CO2电池如下图所示。下列说法错误的是

A. 电池放电时,钠发生氧化反应
B. 正极的电极反应式:2CO2 + 2H2O + 2e- = 2HCO3- + H2↑
C. 理论上消耗23g钠,同时产生22.4L氢气(标准状况)
D. 该装置既可以吸收二氧化碳,又能产生电能、氢燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。下列判断正确的是( )

A. 滤纸上c点附近会变红色
B. Cu电极质量减小,Pt电极质量增大
C. Z中溶液的pH先减小,后增大
D. 溶液中的SO42-向Cu电极定向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质,研究氮氧化物间的相互转化及脱除具有重要意义。
I.氮氧化物间的相互转化
(1)已知2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
第一步 2NO(g)![]() N2O2(g) (快速平衡)
N2O2(g) (快速平衡)
第二步 N2O2(g) + O2(g) = 2NO2(g) (慢反应)
①用O2表示的速率方程为v(O2)=k1c2(NO)c(O2);NO2表示的速率方程为v(NO2)=k2c2(NO)c(O2),k1与k2分别表示速率常数,则![]() =________。
=________。
②下列关于反应2NO(g)+O2(g)=2NO2(g)的说法正确的是_________(填序号)。
A.增大压强,反应速率常数一定增大
B.第一步反应的活化能小于第二步反应的活化能
C.反应的总活化能等于第一步和第二步反应的活化能之和
(2)2NO2(g)![]() N2O4(g)(△H<0),用分压(某组分的分压等于总压与其物质的量分数的积)表示的平衡常数KP与
N2O4(g)(△H<0),用分压(某组分的分压等于总压与其物质的量分数的积)表示的平衡常数KP与![]() (T为温度)的关系如图。
(T为温度)的关系如图。

①能正确表示lgKP与![]() 关系的曲线是________(填“a”或“b”)。
关系的曲线是________(填“a”或“b”)。
②298K时,在体积固定的密闭容器中充入一定量的NO2,平衡时NO2的分压为100kPa。已知KP =2.7×10-3 kPa-1,则NO2的转化率为__________。
II.烟气中氮氧化物的脱除
(3)以NH3为还原剂在脱硝装置中消除烟气中的氮氧化物。
主反应:4NH3(g)+4NO(g)+O2(g)= 4N2(g)+6H2O(g) △H1
副反应:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2=-1267.1kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-907.3 kJ/mol
①△H1=____________。
②将烟气按一定的流速通过脱硝装置,测得出口NO的浓度与温度的关系如图1,试分析脱硝的适宜温度是______(填序号)。温度超过1000 ℃,NO浓度升高的原因是________。
a.<850℃ b.900~1000℃ c.>1050 ℃

(4)以连二亚硫酸盐(S2O42-)为还原剂脱除烟气中的NO,并通过电解再生,装置如图2。阴极的电极反应式为_________,电解槽中的隔膜为_______(填“阳”或“阴”)离子交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分。X、Y、Z、W 均为短周期元素,若W原子最外层电子数是其内层电子数的 ![]() ,则下列说法不正确的是( )
,则下列说法不正确的是( )
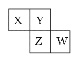
A.X 元素的氢化物分子间可以形成氢键
B.Y 元素的两种同素异形体常温下都是气体
C.最高价氧化物对应水化物的酸性:W>Z
D.阴离子半径从大到小排列顺序为:X>Y>Z>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为短周期主族元素。X、Z、W形成的一种离子是检验Fe3+的常用试剂,X、Y形成的化合物YX3,常用作汽车安全气囊的气体发生剂,W的单质在加热条件下可与X、Z的最高价含氧酸反应。下列叙述正确的是
A. 原子半径:Z>Y>W>X
B. YX3属于离子化合物
C. Y、Z形成的化合物中只含有离子键
D. Z的氧化物对应的水化物属于强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用来表示物质变化的化学用语中,正确的是( )
A. Al2(SO4)3溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH-![]() Al(OH)3
Al(OH)3
B. 以KOH溶液为电解质溶液的氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH-
C. 测0.1mol/L氨水的pH为11:NH3·H2O![]() NH4++OH-
NH4++OH-
D. 钢铁发生吸氧腐蚀的正极反应式:Fe-2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(1)从3min到9min,v(CO2)=__mol·L-1·min-1(计算结果保留2位有效数字)。
(2)能说明上述反应达到平衡状态的是__(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的压强不随时间的变化而变化
C.单位时间内生成1molH2,同时生成1molCH3OH
D.混合气体的平均相对分子质量不随时间的变化而变化
(3)平衡时CO2的转化率为__%。
(4)平衡混合气体中CO2(g)和H2(g)的质量之比是__。
(5)第3分钟时v正(CH3OH)__第9分钟时v逆(CH3OH)(填“>”、“<”“=”或“无法比较”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com