
【题目】今有Fe和Cu的混合物24g,与足量的稀盐酸反应共放出H26.72L(标准状况),求:
(1)原混合物中Fe的物质的量是多少?___
(2)原混合物中Fe的质量分数?___
(3)反应中消耗HCl物质的量是多少?___
科目:高中化学 来源: 题型:
【题目】实验室用碳酸钠晶体配制1.00mol/L的Na2CO3溶液100mL,造成所配溶液浓度偏高的原因是( )
A. 烧杯和玻璃棒没有洗涤
B. 向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤
C. 定容时俯视刻度线
D. 称量碳酸钠晶体(Na2CO310H2O)的烧杯未干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若m g Na在足量氯气中燃烧,生成固体的质量为(m+3.55) g,则m g Na与氧气反应,生成固体的质量可能为( )
①(m+0.8) g ②(m+1.0) g ③(m+1.2) g ④(m+1.6) g ⑤(m+1.8) g
A.仅①④B.仅①⑤
C.①②③④D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源与材料、信息一起被称为现代社会发展的三大支柱。面对能源枯竭的危机,提高能源利用率和开辟新能源是解决这一问题的两个主要方向。
(1)化学反应速率和限度与生产、生活密切相关,这是化学学科关注的方面之一。某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水法收集反应放出的氢气,实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL(标况) | 100 | 240 | 464 | 576 | 620 |
①哪一段时间内反应速率最大:__________min(填“0~1”“1~2”“2~3”“3~4”或“4~5”)。
②另一学生为控制反应速率防止反应过快难以测量氢气体积。他事先在盐酸中加入等体积的下列溶液以减慢反应速率但不影响生成氢气的量。你认为可行的是____________(填字母序号)。
A.KCl溶液 B.浓盐酸 C.蒸馏水 D.CuSO4溶液
(2)如图为原电池装置示意图:

①将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是_______(填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入浓硝酸溶液中形成的原电池的负极反应式:_______________。
②若A为Cu,B为石墨,电解质为FeCl3溶液,工作时的总反应为2FeCl3+Cu=2FeCl2+CuCl2。写出B电极反应式:________;该电池在工作时,A电极的质量将_____(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1mol FeCl3,则转移电子的数目为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分。X、Y、Z、W 均为短周期元素,若W原子最外层电子数是其内层电子数的 ![]() ,则下列说法不正确的是( )
,则下列说法不正确的是( )
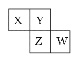
A.X 元素的氢化物分子间可以形成氢键
B.Y 元素的两种同素异形体常温下都是气体
C.最高价氧化物对应水化物的酸性:W>Z
D.阴离子半径从大到小排列顺序为:X>Y>Z>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向20 mL 0.1![]() 的 CH3CH2COOH 溶液中滴加0.1
的 CH3CH2COOH 溶液中滴加0.1![]() 的NaOH溶液,溶液的pH与滴加NaOH溶液体积V的关系如图所示。下列说法正确的是
的NaOH溶液,溶液的pH与滴加NaOH溶液体积V的关系如图所示。下列说法正确的是

A. a 点溶液中 c(CH3CH2COO-) <c(Na+)
B. 图中四点,水的电离程度:c>d>b>a
C. c 点溶液中![]()
D. d 点溶液中c(Na+) +c(OH-) =c(H+) +c(CH3CH2COO-) +c(CH3CH2COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈(Ce)是一种重要的稀土元素。以富含CeO2的废玻璃粉末(含SiO2、 Fe2O3以及其他少量可溶于稀酸的杂质)为原料,采用多种方法回收铈。请回答下列问题:
(1)湿法空气氧化法回收铈的部分流程如下:

已知:CeO2不溶于稀盐酸,也不溶于NaOH溶液。
滤渣的成分是________,反应②的离子方程式是________。
(2)干法空气氧化法回收铈是把Ce(OH)3被空气氧化成Ce(OH)4,氧化过程中发生的化学反应方程式为________。两种制备Ge(OH)4的数据如下表:
干法空气氧化法 | 氧化温度/℃ | 氧化率/% | 氧化时间/h |
暴露空气中 | 110120 | 90 | 18 |
在对流空气氧化炉中 | 110120 | 99 | 8 |
在对流空气氧化炉中大大缩短氧化时间的原因是________。
(3)利用电解方法也可以实现铈的回收。
①在酸性条件下电解Ce2O3 (如图):阳极电极反应式为______,离子交换膜为______ (填“阴”或“阳”)离子交换膜。
②电解产物Ce(SO4)2是重要的氧化剂,将其配成标准溶液,在酸性条件下能测定工业盐中NaNO2的含量,写出发生反应的离子方程式_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去燃煤烟气中的有毒气体,一直是重要的科研课题。某科研小组设计如下装 置模拟工业脱硫脱氮,探究SO2和NO同时氧化的吸收效果。模拟烟气由N2 (90.02%)、SO2(4.99%)、NO(4.99%)混合而成,各气体的流量分别由流量计控制,调节三路气体相应的流量比例,充分混合后进入A。已知:FeSO4+NO![]() [Fe(NO)]SO4(棕色)
[Fe(NO)]SO4(棕色)

(l)仪器A的名称是____,该装置出气管口有两个玻璃球泡,其作用是____。
(2)反应前装置中需要先通入一段时间N2,目的是____,其操作方法是____。
(3)实验中A瓶出现黑色沉淀,写出 A瓶中脱硫反应的离子方程式____。继续实验,现B瓶溶液颜色不变、C瓶溶液出现棕色,这些现象说明____。
(4)关闭活塞e,打开活塞d,在其出气管口,用NO检测仪研究A在不同温度时的脱氮率,实验结果如下图所示,分析图中信息,得出的结论是____。在55℃之前,脱氮率随温度升高而变化的原因可能是____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又是放热反应的是
A. 氢氧化钠与稀硫酸的反应
B. 灼热的木炭与![]() 的反应
的反应
C. 甲烷在空气中燃烧的反应
D. ![]() 晶体与
晶体与![]() 晶体的反应
晶体的反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com