
【题目】下列叙述正确的有___个( )
①用电子式表示MgCl2的形成过程为:![]()
②两个不同种非金属元素的原子间形成的化学键都是极性键
③离子化合物在熔融状态时能够导电
④含有非极性键的化合物一定是共价化合物
⑤元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
⑥次氯酸的电子式:![]()
⑦离子化合物中一定含有离子键
A.1B.2C.3D.4
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分。X、Y、Z、W 均为短周期元素,若W原子最外层电子数是其内层电子数的 ![]() ,则下列说法不正确的是( )
,则下列说法不正确的是( )
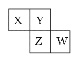
A.X 元素的氢化物分子间可以形成氢键
B.Y 元素的两种同素异形体常温下都是气体
C.最高价氧化物对应水化物的酸性:W>Z
D.阴离子半径从大到小排列顺序为:X>Y>Z>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸式盐NaHB在水溶液中,HB-的电离程度小于HB-的水解程度,下列说法正确的是( )
A. HB—水解方程式:HB-+H2O![]() H3O++B2- B. 相同物质的量浓度溶液的pH值:NaHB > Na2B
H3O++B2- B. 相同物质的量浓度溶液的pH值:NaHB > Na2B
C. NaHB的存在抑制了水的电离 D. 溶液中离子浓度大小为:c(Na+)>c(HB-)>c(OH-) >c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气的反应化学方程式如下:(用元素符号或化学式表示)
MnO2+4HCl(浓)= MnCl2+Cl2↑+2H2O
(1)还原剂是:______;氧化产物是 _________;
(2)被氧化的原子与被还原的原子个数之比为____
(3)请用双线桥法表示反应的电子转移方向和数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(1)从3min到9min,v(CO2)=__mol·L-1·min-1(计算结果保留2位有效数字)。
(2)能说明上述反应达到平衡状态的是__(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的压强不随时间的变化而变化
C.单位时间内生成1molH2,同时生成1molCH3OH
D.混合气体的平均相对分子质量不随时间的变化而变化
(3)平衡时CO2的转化率为__%。
(4)平衡混合气体中CO2(g)和H2(g)的质量之比是__。
(5)第3分钟时v正(CH3OH)__第9分钟时v逆(CH3OH)(填“>”、“<”“=”或“无法比较”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又是放热反应的是
A. 氢氧化钠与稀硫酸的反应
B. 灼热的木炭与![]() 的反应
的反应
C. 甲烷在空气中燃烧的反应
D. ![]() 晶体与
晶体与![]() 晶体的反应
晶体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)漂白粉的有效成分是_____。
(2)高炉炼铁中存在反应:3CO+Fe2O3![]() 3CO2+2Fe,该反应中氧化剂是_____。
3CO2+2Fe,该反应中氧化剂是_____。
(3)1.2g RSO4中含0.01molR2+,则RSO4的摩尔质量是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度
B.当一个可逆反应达到平衡状态时,这个反应的正反应速率和逆反应速率相等
C.可以通过控制反应条件,使2 mol SO2与1 mol O2反应生成2 mol SO3
D.化学反应的限度可以通过改变条件来改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(V)为过渡元素,可形成多价态化合物,全钒液流电池是一种新型的绿色环保储能系统,工作原理如下图:

已知:
离子种类 | VO2+ | VO2+ | V3+ | V2+ |
颜色 | 黄色 | 蓝色 | 绿色 | 紫色 |
(1)全钒液流电池放电时V2+发生氧化反应,该电池放电时总反应式是_______
(2)当完成储能时,正极溶液的颜色是 __________
(3)质子交换膜的作用是_________
(4)含钒废水会造成水体污染,对含钒废水(除VO2+外,还含Fe3+等)进行综合处理可实现钒资源的回收利用,流程如下:

已知溶液酸碱性不同钒元素的存在形式不同:
钒的化合价 | 酸性 | 碱性 |
+4价 | VO2+ | VO(OH)3- |
+5价 | VO2+ | VO43- |
①滤液中钒元素的主要存在形式为_______
②滤渣在空气中由灰白色转变为红褐色,用化学用语表示加入NaOH后生成沉淀的反应过程_______________、____________。
③萃取、反萃取可实现钒的分离和富集,过程可简单表示为(HA为有机萃取剂):
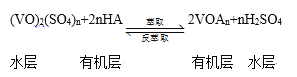
萃取时必须加入适量碱,其原因是 __________
④纯钒可由熔盐电解法精炼,粗钒(含杂质)作____极。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com