
��ҵ�ϣ�����ͭ��CuFeS2��ͨ��8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2��Ӧ��ȡͭ����������Ļ����
8Cu+4FeO+2Fe2O3+16SO2��Ӧ��ȡͭ����������Ļ����
��1��������Ӧ�У���ԭ��Ϊ ��
��2����ͭ��ұ��ͭ������¯������Fe2O3��FeO��SiO2��Al2O3�����Ʊ�Fe2O3������Ϊ��
����ϡ�����ȡ¯�������ˡ�
����Һ���������ټ������NaOH��Һ�����ˣ�������ϴ�ӡ�������յ�Fe2O3��
��������Ϣ�ش��������⣺
a��ͨ�������ڣ�¯���е�Al2O3����� ��д���ӣ���
b��ѡ���ṩ���Լ������ʵ����֤¯���к���FeO��
�ṩ���Լ���ϡ���� ϡ���� KSCN��Һ ����KMnO4��Һ NaOH��Һ ��ˮ
��ѡ�Լ�Ϊ ��
֤��¯���к���FeO��ʵ������Ϊ ��
��3��������¯���н��к������IJⶨ�������£�
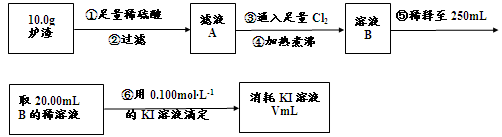
I������۷�����Ӧ�����ӷ���ʽΪ ��
II����������������� ��
III����������õ��IJ����������ձ�������������ͷ�ιܡ� ��
IV�����ζ�����������0.100mol��L−1KI��Һ20.00mL����¯�������İٷֺ���Ϊ ��
��1��CuFeS2 ��2��a��[Al(OH)4]- ��AlO2- b��ϡ���ᡢ����KMnO4��Һ��ϡ�����ȡ¯��������Һʹ����KMnO4��Һ��ɫ��3��I��2Fe2++Cl2= 2Fe3++2Cl-II��������Һ���ܽ�Ĺ�����Cl2 III��250mL����ƿ ��δ��250mL�������֣�IV��14%
��������
�����������1���ڷ�Ӧ��CuFeS2����Ԫ�صĻ��ϼ���+2�۱�Ϊ+3�ۣ���Ԫ�صĻ��ϼ���-2�۱�Ϊ+4������ԭ������2������ϡ�����ȡ¯�������ķ�ӦΪ��Al2O3 + 6H+=2Al3+ + 3H2O
FeO + 2H+ = Fe2+ + H2O Fe2O3 + 6H+ = 2Fe3+ + 3H2O ����Һ�к��еĽ�����������Al3+��Fe2+ ��Fe3+����������Al3+��Fe3+���ӹ�������������Һ�����ķ�Ӧ��Al3+ + 4OH-=AlO2- + 2H2O Fe3+ + 3OH- = Fe(OH)3�� a��ͨ�������ڣ�¯���е�Al2O3�����AlO2- ��b��֤¯���к���+2�۵�����Ӧ�ȼ���ϡ�����ܽ⣬�����������ӣ����л�ԭ�ԣ����������ط���������ԭ��Ӧ���ữʱ���ܼ������ᣬ�����������ط���������ԭ��Ӧ��Ҳ����ֱ�Ӽ������ᣬ�������������ӣ����ܼ��飬�ʴ�Ϊ��ϡ���ᡢKMnO4��Һ��ϡ�����ȡ¯��������Һ�����������ӣ��������ط���������ԭ��Ӧ��ʹ���������ɫ���ʴ�Ϊ��ϡ�����ȡ¯��������Һ��ʹKMnO4��Һ��ɫ����3��������������ͼ�����ķ�ӦΪ��¯��������ϡ���Al2O3 + 6H+=2Al3+ + 3H2O FeO + 2H+ = Fe2+ + H2O Fe2O3 + 6H+ = 2Fe3+ + 3H2O���ˣ���Һ�к��еĽ�����������Al3+��Fe2+ ��Fe3+��ͨ������Cl2��2Fe2+ + Cl2 = 2Fe3+ + 2Cl- �ζ�ԭ����2Fe3+ + 2I- = 2Fe2+ + I2I�������ͨ����������������Ӧ�����ӷ���ʽΪ2Fe2+ + Cl2 = 2Fe3+ + 2Cl- ��II������������������I-����Ӱ��ʵ���������Բ��������е������Ǹ�����Һ���ܽ�Ĺ�����Cl2����III�������Ϊ��Һ�����ƣ��õ��IJ����������ձ�������������ͷ�ιܡ�250mL����ƿ��IV���ζ������з����ķ�ӦΪ2Fe3+ + 2I- = 2Fe2+ + I2���ɷ�Ӧʽ֪n(I-)= n(Fe3+)=0.002mol���������ͼ֪10.0g¯�����������ʵ���Ϊ0.025mol������Ϊ1.4g,��������Ϊ14%��
���㣺�Ի�ѧ��������Ϊ���忼��������ԭ��Ӧ��������������Ļ���������ʡ���Һ�������Լ���ϵʽ�����㡣


 ��У���˳�̾�ϵ�д�
��У���˳�̾�ϵ�д� ��У���һ��ͨϵ�д�
��У���һ��ͨϵ�д� �γ̴����Ծ�����100��ϵ�д�
�γ̴����Ծ�����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| Ksp | �������↑ʼ����ʱ��pH | �������������ȫʱ��pH | |
| Fe3+ | 2.6��10-39 | 1.9 | 3.2 |
| Cu2+ | 2.2��10-20 | 4.7 | 6.7 |
| ||
| ||
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�긣��ʡȪ���и����ʼ����ۻ�ѧ�Ծ��������棩 ���ͣ������
��ҵ���Ի�ͭ��(��Ҫ�ɷ�CuFeS2)Ϊԭ���Ʊ�����ͭ�����������ֹ��ա�
I.����������:���������Ļ�ͭ�����ʯӢ����ͨ�˿������б��գ������Ƶô�ͭ��
��1�����յ��ܷ�Ӧʽ�ɱ�ʾΪ��2CuFeS2 + 2SiO2+5O2��2Cu+2FeSi03+4SO2�÷�Ӧ����������_____��
��2�����д���SO2�ķ���������������_____
A.�߿��ŷ�
B.�ô�����Һ�����Ʊ���������
C.�ð�ˮ���պ��پ������Ʊ������
D.��BaCl2��Һ�����Ʊ�BaSO3
��3��¯����Ҫ�ɷ���FeO ��Fe2O3 ��SiO2 ,Al2O3�ȣ�Ϊ�õ�Fe2O3�������ܽ��������������,δ�漰���IJ�����_____��
A���ˣ�B�ӹ���NaOH��Һ��C�����ᾧ��D���գ�E��������
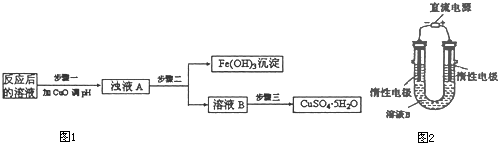
II.FeCl3��Һ��ȡ����:��������������ͼ��ʾ

��4�����������У�CuFeS2��FeCl3��Һ��Ӧ�����ӷ���ʽΪ? _____________��
��5���ù��������У�����ѭ�����õ�������_____(�ѧʽ)��
��6������ʯī�缫�����Һ��д�������ĵ缫��ʽ_____________��
��7����ͭ���к�����Pb,����C1һŨ�ȿɿ�����Һ��Pb2+��Ũ�ȣ���c(C1һ)��2mo1��L-1ʱ��Һ��Pb2+���ʵ���Ũ��Ϊ__mol��L-1��[��֪KSP(PbCl2)��1 x 10һ5]
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com