
【题目】通常情况下,氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如下图所示
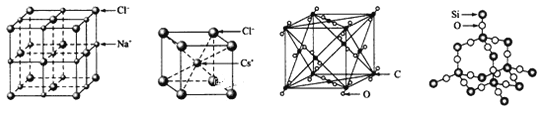
(1) 在NaCl的晶胞中,与Na+最近且等距的Na+有_____个,在NaCl的晶胞中有Na+_____个,Cl-____个
(2)在CsCl的晶胞中,Cs+与Cl-通过_________结合在一起。
(3) 1mol二氧化硅中有______mol硅氧键。
(4)设二氧化碳的晶胞密度为a g/cm3,写出二氧化碳的晶胞参数的表达式为____n m (用含NA的代数式表示)
【答案】12 4 4 离子键 4 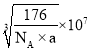
【解析】
(1)氯化钠晶体中氯离子位于定点和面心,钠离子位于边和体心;
(2)阴、阳离子之间的静电作用为离子键;
(3)二氧化硅是原子晶体,每个硅原子与4个氧原子形成硅氧键;
(4)晶胞中CO2分子数目为8![]() +6
+6![]() =4,晶胞的质量为
=4,晶胞的质量为![]() g,晶胞的体积为(anm)3=(a×10-7cm)3,晶胞的密度
g,晶胞的体积为(anm)3=(a×10-7cm)3,晶胞的密度![]() 。
。
(1)晶胞中位于体心的钠离子和位于边上Na+的短离最近,则最近且等距的Na+共有12个Na+;晶胞中Na+的个数为1+12![]() =4,Na+的个数为8
=4,Na+的个数为8![]() +6
+6![]() =4;
=4;
(2)在CsCl的晶胞中,Cs+与Cl-通过离子键结合在一起;
(3)二氧化硅是原子晶体,每个硅原子与4个氧原子形成硅氧键,则1mol二氧化硅中有4mol硅氧键;
(4)晶胞中CO2分子数目为8![]() +6
+6![]() =4,晶胞的质量为
=4,晶胞的质量为![]() g,晶胞的体积为(anm)3=(a×10-7cm)3,晶胞的密度
g,晶胞的体积为(anm)3=(a×10-7cm)3,晶胞的密度![]() ,则a=
,则a= nm=
nm=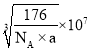 nm。
nm。


科目:高中化学 来源: 题型:
【题目】一定量的铁与一定量的浓HNO3在加热条件下恰好完全反应,得到硝酸铁溶液和NO2 、N2O4 、NO的混合气体,这些气体与6.72 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铁溶液中加入2 mol·L-1 的NaOH 溶液至Fe3+恰好沉淀,则消耗NaOH 溶液的体积是( )
A. 600 mLB. 300 mLC. 240 mLD. 180 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式为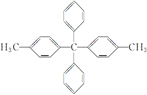 ,对该有机物分子的描述正确的是( )
,对该有机物分子的描述正确的是( )
A. 最多有7个碳原子共线
B. 所有碳原子都在同一平面上
C. 其一氯代物最多有5种
D. 最多有25个原子共面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与纯水的电离相似,液氨中也存在着微弱的电离:2NH3![]() NH4++NH2-,据此判断,以下叙述错误的是( )
NH4++NH2-,据此判断,以下叙述错误的是( )
A.一定温度下液氨中c(NH4+)·c(NH2-)是一个常数
B.液氨中含有NH3、NH4+、NH2-等粒子
C.只要不加入其他物质,液氨中c(NH4+)=c(NH2-)
D.液氨达到电离平衡时c(NH3)=c(NH4+)=c(NH2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.写出下列有机物的系统命名或结构简式:
(1)![]() ____________。
____________。
(2)CH3CH(CH3)C(CH3)2CH2CH3____________。
(3) 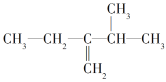 ________。
________。
Ⅱ.食品安全关系着国民生计,影响食品安全的因素很多。
(1)聚偏二氯乙烯(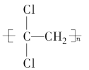 )具有超强阻隔性能,可作为保鲜食品的包装材料。它是由________(写结构简式)发生加聚反应生成的。
)具有超强阻隔性能,可作为保鲜食品的包装材料。它是由________(写结构简式)发生加聚反应生成的。
(2)劣质植物油中的亚油酸[CH3(CH2)4—CH=CH—CH2—CH=CH—(CH2)7COOH]含量很低。下列关于亚油酸的说法中,正确的是________。
A.分子式为C18H34O2 B.一定条件下能与甘油(丙三醇)发生酯化反应
C.能和NaOH溶液反应 D.能使酸性KMnO4溶液褪色
(3)假酒中甲醇(CH3OH)含量超标,请写出Na和甲醇反应的化学方程式:_______。
(4)劣质奶粉中蛋白质含量很低。蛋白质水解的最终产物是________________。
(5)在淀粉中加入吊白块制得的粉丝有毒。淀粉最终的水解产物是葡萄糖。请设计实验证明淀粉已经全部水解,写出操作、现象和结论:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法正确的组合是( )
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2-相紧邻
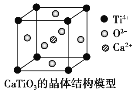
(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点)
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②④⑥B.①②③C.③⑤⑧D.③⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶胞结构如图所示。下列说法中错误的是( )
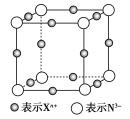
A.晶体中每个Xn+周围有2个等距离且最近的N3-
B.该晶体中阳离子与阴离子的个数比为3︰1
C.n=1
D.Xn+的核外电子数为18
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌、硫化锌都是重要的基础化工原料。
(1)ZnO是两性氧化物,ZnO在NaOH溶液中转化成[Zn(OH)4]2-的离子方程式为_____________________________________________________。
(2)火法炼锌得到的氧化锌中含有铅、铜等杂质,提纯步骤如下:
![]()
反应Ⅰ ZnO(s)+CO(g) ![]() Zn(g)+CO2(g) △H1
Zn(g)+CO2(g) △H1
反应Ⅱ 2 Zn(g)+ O2(g)=2 ZnO(s) △H2
①上图中的“冷凝物”为________(填化学式)。
②某温度时,在反应Ⅰ的反应炉中,起始时c(CO)为0.3 molL-1,反应过程中CO2的体积分数φ(CO2)如图所示,则反应Ⅰ的平衡常数K=_______________。
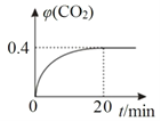
③下列措施有利于提高反应Ⅰ中 ZnO 转化率的是________。
a.增大ZnO的投料量 b.适当加压 c.将锌蒸气及时分离
④反应Ⅱ中,每转移 1 mol 电子,反应放热 174 kJ,则△H2=_____________。
(3)测定氧化锌样品纯度:称取0.5000 g样品,酸溶后定容于250 mL容量瓶中,摇匀。量取25.00 mL 该溶液,用0.04000 molL-1的EDTA(Na2H2Y)标准溶液滴定其中的Zn2+(反应方程式为Zn2++H2Y2-=ZnY2-+2H+,杂质不反应),平行滴定三次,平均消耗EDTA标准溶液15.12 mL。
①若滴定管未用 EDTA 标准液润洗,测定结果将__________(填“偏高”、“偏低”或“不变”)。
②样品纯度为___________(保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学土肥外加少量酸、碱,而pH基本不变的溶液,称为缓冲溶液,现有25℃时,浓度均为0.10mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76,回答下列问题:
[Ka(CH3COOH)=1.75×10-5,Kb为盐的水解常数]
(1)CH3COOH的电离方程式为__。
(2)该缓冲溶液中离子浓度由大到小的顺序是___。
(3)25℃时,Ka(CH3COOH)___Kb(CH3COO-)(填“>”“<”或“=”)。
(4)用1.0L上述缓冲溶液中滴加几滴NaOH稀溶液(忽略溶液体积的变化),反应后溶液中c(H+)__mol/L。
(5)人体血液存在H2CO3(CO2)与NaHCO3的缓冲体系,能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定,有关机理说法正确的是__(填写选项字母)。
a.代谢产生的![]() 被HCO3-结合形成H2CO3
被HCO3-结合形成H2CO3
b.血液中的缓冲体系可抵抗大量酸、碱的影响
c.代谢产生的碱被H+中和,H+又由H2CO3电离补充
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com