
【题目】化学土肥外加少量酸、碱,而pH基本不变的溶液,称为缓冲溶液,现有25℃时,浓度均为0.10mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76,回答下列问题:
[Ka(CH3COOH)=1.75×10-5,Kb为盐的水解常数]
(1)CH3COOH的电离方程式为__。
(2)该缓冲溶液中离子浓度由大到小的顺序是___。
(3)25℃时,Ka(CH3COOH)___Kb(CH3COO-)(填“>”“<”或“=”)。
(4)用1.0L上述缓冲溶液中滴加几滴NaOH稀溶液(忽略溶液体积的变化),反应后溶液中c(H+)__mol/L。
(5)人体血液存在H2CO3(CO2)与NaHCO3的缓冲体系,能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定,有关机理说法正确的是__(填写选项字母)。
a.代谢产生的![]() 被HCO3-结合形成H2CO3
被HCO3-结合形成H2CO3
b.血液中的缓冲体系可抵抗大量酸、碱的影响
c.代谢产生的碱被H+中和,H+又由H2CO3电离补充
【答案】CH3COOH![]() CH3COO-+H+ c(CH3COO-)>c(Na+)> c(H+)> c(OH-) >
CH3COO-+H+ c(CH3COO-)>c(Na+)> c(H+)> c(OH-) > ![]() ac
ac
【解析】
(1)CH3COOH是弱电解质;
(2)根据电荷守恒,该缓冲溶液中c(CH3COO-)+c(OH-)= c(Na+)+c(H+),pH=4.76,c(OH-)< c(H+);
(3)Kb(CH3COO-)=![]() ;
;
(4)加少量酸、碱,缓冲溶液pH基本不变;
(5)根据平衡移动原理分析;
(1)CH3COOH是弱电解质,CH3COOH的电离方程式为CH3COOH![]() CH3COO-+H+ ;
CH3COO-+H+ ;
(2)根据电荷守恒,该缓冲溶液中c(CH3COO-)+c(OH-)= c(Na+)+c(H+),pH=4.76,c(OH-)< c(H+),离子浓度由大到小的顺序是c(CH3COO-)>c(Na+)> c(H+)> c(OH-);
(3)Kb(CH3COO-)=![]() ,所以Ka(CH3COOH) >Kb(CH3COO-);
,所以Ka(CH3COOH) >Kb(CH3COO-);
(4)加少量酸、碱,缓冲溶液pH基本不变,用1.0L上述缓冲溶液中滴加几滴NaOH稀溶液(忽略溶液体积的变化),反应后溶液pH=4.76,所以c(H+)=![]() mol/L;
mol/L;
(5)a. 缓冲体系中存在H2CO3- HCO3-,代谢产生的![]() 被HCO3-结合形成H2CO3,被血液带到肺部分解成二氧化碳和水,故a正确;
被HCO3-结合形成H2CO3,被血液带到肺部分解成二氧化碳和水,故a正确;
b.血液中的缓冲体系可抵抗少量酸、碱的影响,故b错误;
c. 代谢过程产生碱性物进入血液时,H2CO3立即与OH-作用,生成H2O和HCO3-,经肾脏调节由尿排出,故c正确。


科目:高中化学 来源: 题型:
【题目】通常情况下,氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如下图所示
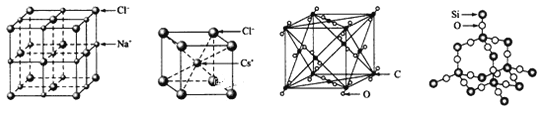
(1) 在NaCl的晶胞中,与Na+最近且等距的Na+有_____个,在NaCl的晶胞中有Na+_____个,Cl-____个
(2)在CsCl的晶胞中,Cs+与Cl-通过_________结合在一起。
(3) 1mol二氧化硅中有______mol硅氧键。
(4)设二氧化碳的晶胞密度为a g/cm3,写出二氧化碳的晶胞参数的表达式为____n m (用含NA的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用电子式表示H2O和MgBr2的形成过程:
H2O_________
MgBr2__________
(2)写出CO2、Na2O2、H2O2的电子式:
CO2___________Na2O2________ H2O2________
(3)A+、B+、C-、D、E 5种离子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:
A.A++ C- → D + E b.B++ C- → 2D 。据此回答下列问题:
①写出A反应的离子方程式________;
②写出A+、C-离子的电子式:A+________ C-__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数递增的短周期主族元素,R为过渡元素。Y的最高价氧化物的水化物是强酸,Z元素的基态原子中有2个未成对电子,基态W原子的价电子排布式为nsn-1npn-1,X与W为同主族元素。基态R原子的M能层全充满,核外有且仅有1个未成对电子。请回答下列问题:
(1)基态R原子核外价电子排布式为___。
(2)X、Y、Z三种元素的第一电离能由大到小的顺序为___(填元素符号)。
(3)元素Y的简单气态氢化物的沸点___(填“高于”或“低于”)元素X的简单气态氢化物的沸点,其主要原因是___;元素Y的简单气态氢化物中Y原子的杂化类型为___,元素X的简单气态氢化物分子的空间构型为___。
(4)Y的气态氢化物在水中可形成氢键,其氢键最可能的形式为___(填序号)。
A.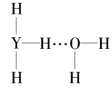 B.
B. 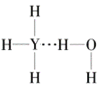 C.
C.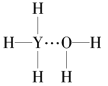 D.
D.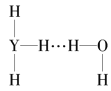
(5)R元素与Y元素形成的某种化合物的晶胞结构如图所示(黑球代表R原子),若该晶胞的边长是acm,则该晶体的密度为___g·cm-3(用NA表示阿伏加德罗常数的值)。
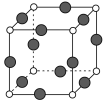
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小分子抗癌药物的分子结构如图所示,下列说法正确的是

A. 1mol该有机物最多可以和5mol NaOH反应
B. 该有机物容易发生加成、取代、中和、消去等反应
C. 该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色
D. 1mol该有机物与浓溴水反应,最多消耗3mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,最近有科学家设计了一种在常压下运行的集成BaZrO3基质子陶瓷膜反应器( PCMR) ,将PCMR与质子陶瓷燃料电池相结合进行电化学法合成氨的原理如图所示,下列说法正确的是
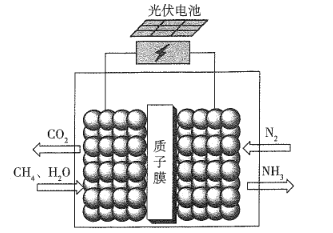
A.阳极的电极反应式为CH4+2H2O+8e-=CO2 +8H+
B.阴极可能发生副反应2H+ +2e- =H2 ↑
C.质子(H+)通过交换膜由阴极区向阳极区移动
D.理论上电路中通过3 mol电子时阴极最多产生22.4 L NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在温度T1和T2时水的电离平衡曲线如图所示,下列说法错误的是
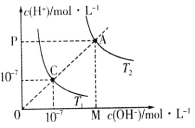
A.图中矩形OMAP的面积可以表示T2时水的离子积的值
B.水的离子积常数关系为:C > A
C.升高温度可实现由C点到A点
D.T1时,pH=4的硫酸与pH=l0的氢氧化钠溶液等体积混合,所得溶液的pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.向沸水中滴加![]() 溶液制备
溶液制备![]() 胶体:
胶体:![]()
B.用![]() 溶液腐蚀印刷铜电路板:
溶液腐蚀印刷铜电路板:![]()
C.用小苏打治疗胃酸过多:![]()
D.实验室用浓盐酸与![]() 反应制
反应制![]() :
:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)![]() 4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是![]()
B. 此时,B的平衡转化率是35%
C. 增大该体系的压强,平衡向右移动,化学平衡常数增大
D. 增大C,B的平衡转化率不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com